Printemps 2021 (Volume 31, numéro 1)
SIME et SIMP :
la « soupe à l’alphabet » de l’hyperinflammation
liée à la COVID chez les enfants
Par Tala El Tal, M.D.; et Rae S. M. Yeung, M.D., FRCPC, Ph. D.
Télécharger la version PDF
Cas du patient :
Un garçon de huit ans, originaire du sud de l’Asie, auparavant en bonne santé, est emmené au service des urgences après quatre
jours de fièvre persistante, de douleurs abdominales, de vomissements et de diarrhée, accompagnés d’une conjonctivite bilatérale
non purulente, d’une éruption cutanée sur la poitrine, les membres inférieurs et la paume des mains, ainsi que de rougeur, d’enflure
et de gerçures des lèvres. Quatre semaines auparavant, son père a reçu un résultat positif au coronavirus 2 du syndrome respiratoire
aigu sévère (SRAS-CoV-2) sur prélèvement nasopharyngé. À l’époque, le garçon était asymptomatique et n’a pas subi de test de dépistage.
À son arrivée au service des urgences, il présentait une hypotension artérielle (78/47 mm Hg) et sa fréquence cardiaque était de
150 battements/min malgré l’administration de 40 ml/kg de liquide. Il était froid au toucher et présentait un allongement du temps de
remplissage capillaire.
À son admission, les résultats de laboratoire étaient significatifs : taux de protéine C-réactive (CRP) nettement élevé, thrombocytopénie,
lymphopénie, hyperferritinémie, hypoalbuminémie, hypertriglycéridémie, taux d’enzymes hépatiques élevé, coagulopathie
et taux de troponine I et de peptides natriurétiques NT-proBNP (N-terminal-pro-Brain Natriuretic Peptide) nettement élevés. Un échocardiogramme
a mis en évidence une réduction de la fonction systolique du ventricule gauche et une dilatation de l’artère descendante
antérieure gauche. Un électrocardiogramme (ECG) a montré des anomalies non spécifiques de l’onde T. Les résultats des tests de détection
répétés du SRAS-CoV-2 par PCR sur des prélèvements nasopharyngés étaient indéterminés, mais les tests sérologiques ont révélé
la présence d’anticorps IgG anti-COVID-19. Un syndrome inflammatoire multisystémique chez l’enfant (SIME), également connu sous le
nom de syndrome inflammatoire multisystémique pédiatrique (SIMP), temporellement associé au SRAS-CoV-2, a été diagnostiqué chez
l’enfant. Il a été admis à l’unité de soins intensifs (USI) où il a nécessité un traitement inotrope pour sa dysfonction cardiaque. Il a aussi
reçu des immunoglobulines par voie intraveineuse (IgIV) et des stéroïdes comme agents immunosuppresseurs afin de lutter contre
l’hyperinflammation, ainsi que des doses antiplaquettaires d’AAS. Son état de santé s’est amélioré de façon spectaculaire, puisqu’il n’a
été hospitalisé que quatre jours, dont les deux premiers à l’USI. À sa sortie de l’hôpital, on lui a prescrit un sevrage des stéroïdes sur une
période de trois semaines. Il s’est complètement rétabli et n’a pas présenté de séquelles cardiovasculaires à long terme.
Au début de la pandémie de COVID-19, on pensait que la
plupart des enfants étaient asymptomatiques ou qu’ils
présentaient des manifestations bénignes de la maladie. À
partir d’avril 2020, les cliniciens travaillant dans les épicentres de
la COVID-19 ont observé l’émergence de grappes de cas d’enfants
d’âge scolaire présentant de la fièvre et des caractéristiques de la
maladie de Kawasaki (MK) et du syndrome du choc toxique (SCT)
à la suite des éclosions de COVID-19 dans leurs communautés.
Des alertes ont été lancées auprès de la communauté médicale,
et différents noms et différentes définitions de cas ont été proposés
(rendez-vous sur www.cps.ca/fr/documents/position/SIME pour plus d’information)1. Pour les besoins de cet article, le terme
SIME sera utilisé. Cette brève mise à jour portera principalement
sur trois questions pratiques :
- Quand soupçonner le SIME?
- Comment aborder l’évaluation diagnostique du SIME?
- Comment traiter le SIME?
Quand soupçonner le SIME?
Les signes et les symptômes du SIMCE coïncident largement avec
ceux de la maladie de Kawasaki (MK) et du syndrome du choc
toxique (SCT). La MK est un syndrome hyperinflammatoire qui se
présente sous la forme d’une vascularite multisystémique aiguë
touchant les jeunes enfants. Les principales caractéristiques sont
les suivantes : (1) infection conjonctivale bilatérale; (2) éruption
cutanée polymorphe; (3) érythème et oedème des mains et/ou
des pieds, (4) lymphadénopathie cervicale, et (5) modifications
touchant la muqueuse buccale, en présence d’au moins 5 jours de
fièvre. On sait que la MK a une prédilection pour les artères coronaires,
où un anévrisme se forme dans 25 % des cas non traités2.
De même, les enfants atteints de SIME présentent une fièvre
persistante et une atteinte multiorganique (cardiaque, hématologique,
gastro-intestinale, neurologique, rénale et/ou dermatologique)
survenant généralement de 3 à 6 semaines après une
exposition au SRAS-CoV-233,4, ce qui évoque une hyperinflammation
postinfectieuse sous-jacente à la biopathologie5. Comme
la MK, le SIME est un syndrome présentant un large éventail de
phénotypes cliniques. Divers syndromes d’hyperinflammation associés
à la COVID-19 a été proposé6,7 avec trois schémas cliniques
parallèlement au spectre d’hyperinflammation dans le SIME :
choc, MK et fièvre avec inflammation, reflétant le continuum
de la gravité de la maladie. Les premiers rapports faisaient état
des principales caractéristiques cliniques suivantes : myocardite,
dysfonction myocardique et choc manifeste nécessitant un traitement
inotrope. Certains patients ont présenté un anévrisme
coronarien, ainsi qu’un syndrome d’activation macrophagique (SAM). Il a également été observé que le SIME touche généralement
les enfants en bonne santé et, de manière disproportionnée,
les enfants de type non caucasien, les enfants d’origine africaine,
hispanique et sud-asiatique étant davantage touchés. La contribution
de facteurs environnementaux et/ou génétiques n’a pas
été élucidée, des taux plus élevés de COVID-19 ayant été constatés
dans les communautés touchées.
Comment aborder l’évaluation diagnostique du SIME?
Le degré de suspicion du SIME doit être élevé chez les enfants
vivant dans les zones où la prévalence de la COVID-19 est élevée
et qui présentent une fièvre prolongée de même que des caractéristiques
d’inflammation à l’observation clinique et aux résultats
de laboratoire. Le SIME est généralement précédé d’une infection
connue par le SRAS-CoV-2 chez l’enfant ou un membre de
la famille plusieurs semaines avant l’apparition du syndrome. Les
enfants peuvent présenter des caractéristiques de la MK et/ou du
SCT et, souvent, les douleurs abdominales et autres signes gastro-
intestinaux sont importants. Il convient de noter que le SIME
est un diagnostic d’élimination et que d’autres causes de maladie
fébrile chez les enfants, y compris d’autres étiologies infectieuses
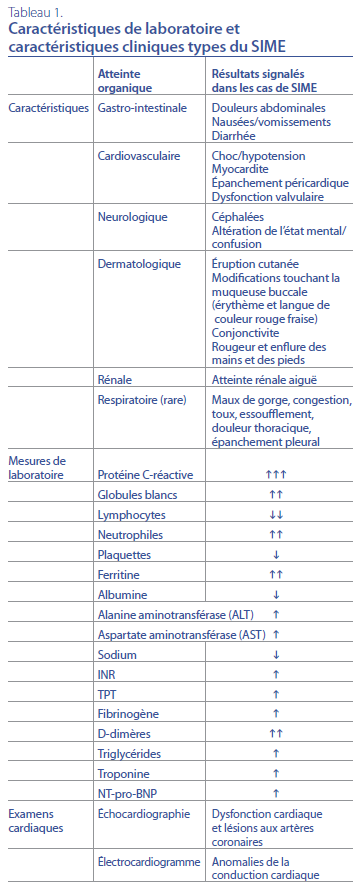
et non infectieuses, doivent être considérées. Le tableau 1 résume
les résultats de laboratoire et les observations cliniques
généralement signalés dans les cas de SIME. Les patients présentent
des signes d’un état hyperinflammatoire, qui se manifeste
par des résultats de laboratoire indiquant un taux de protéine
C-réactive (CRP) nettement élevé et des mesures compatibles
avec une infection virale (lymphopénie) et un SAM, y compris
une thrombocytopénie et un taux de ferritine sérique élevé6 qui,
avec l’hyponatrémie, et des taux de troponine et de NT-pro-BNP
élevés, constituent des résultats de laboratoire préoccupants qui
évoquent un phénotype de maladie plus grave8.
Comment traiter le SIME?
Bien que la littérature sur le SIME s’enrichisse rapidement, la prise
en charge s’est principalement appuyée sur les connaissances extrapolées
du traitement de la MK. Plusieurs groupes ont réuni des
experts afin d’élaborer des lignes directrices, notamment l’American
College of Rheumatology (ACR), qui a rédigé des lignes directrices
pour l’évaluation et le traitement du SIME8. Les enfants
atteints de SIME admis à l’hôpital doivent être pris en charge
par une équipe multidisciplinaire (rhumatologie, cardiologie et
autres surspécialités, selon les besoins). La pierre angulaire du
traitement est l’immunomodulation. Le traitement recommandé
pour tous les enfants devant être hospitalisés en raison d’un SIME
consiste en une immunosuppression progressive, en commençant
par une forte dose d’IgIV (2 g par kg par dose) comme traitement
de première intention. Un traitement d’appoint par glucocorticoïdes
à dose faible ou modérée (prednisone 1-2 mg/kg/j) est
recommandé chez les patients gravement atteints présentant un
risque élevé de graves complications coronariennes, ou comme
traitement en cas d’échec des IgIV. Chez les patients qui présentent
une atteinte d’un organe critique nécessitant un traitement
inotrope, ou chez ceux qui présentent une résistance aux
IgIV et aux stéroïdes à dose faible ou modérée, il est recommandé
d’administrer des glucocorticoïdes à forte dose (de 10 à 30 mg/
kg/j). L’administration d’antagonistes de l’IL-1, comme l’anakinra
(> 4 mg/kg/j), peut être envisagée chez les patients dont la maladie
est réfractaire aux IgIV et à la corticothérapie, ainsi que chez ceux
qui présentent des caractéristiques du SAM. Un suivi rigoureux,
au moyen d’analyses de laboratoire et d’examens cardiaques en
série, permettra de déterminer la durée de l’immunosuppression
et la diminution de la dose, avec un sevrage général des stéroïdes
sur une période de 2 à 3 semaines, voire plus, étant donné le taux
élevé de rebond de l’inflammation constaté en cas de diminution plus rapide8. D’autres traitements immunomodulateurs ont été
utilisés et décrits dans la littérature, notamment le tocilizumab
(inhibiteur de l’IL-6) et l’infliximab (inhibiteur du TNF)9,10, mais
les données disponibles sont insuffisantes pour que l’on puisse
formuler des recommandations claires. Comme dans les cas de
MK, les patients atteints de SIME sont traités avec de l’AAS à faible
dose (de 3 à 5 mg par kg par jour) comme thromboprophylaxie
antiplaquettaire. Une anticoagulothérapie par l’enoxaparine doit
être envisagée chez les patients atteints d’un SIME et présentant
des anévrismes des artères coronaires, conformément aux directives
de prise en charge de la MK, et chez ceux qui présentent
un dysfonctionnement modéré ou grave du ventricule gauche
(fraction d’éjection < 35 %)8.
Il est recommandé de procéder à des mesures en série des paramètres
cliniques et de laboratoire, y compris par ECG et échographie,
dans le cadre du suivi complet suivant la sortie de l’hôpital.
En résumé, le SIME est un syndrome hyperinflammatoire postinfectieux
temporellement associé aux infections par le SRASCoV-
2 chez les enfants. Il existe un vaste éventail de maladies
dont beaucoup partagent des caractéristiques avec la MK, et les
enfants les plus gravement touchés présentant un choc cardiogénique
et un SAM. L’immunomodulation est le fondement de la
prise en charge thérapeutique, la plupart des enfants répondant
rapidement au traitement. Le SIM reste une complication rare de
l’infection par le SRAS-CoV-2.
Rae S. M. Yeung, M.D., FRCPC, Ph. D.
Chaire Hak-Ming et Deborah Chiu de recherche en
pédiatrie translationnelle
Professeure de pédiatrie, d’immunologie et de sciences médicales,
Université de Toronto
Chercheuse principale et rhumatologue, The Hospital for Sick Children
Toronto (Ontario)
Tala El Tal, M.D.
Division de rhumatologie, The Hospital for Sick Children
Toronto (Ontario)
Références et lectures suggérées :
4. Berard RA, Scuccimarri R, Haddad EM, et coll. Paediatric inflammatory multisystem syndrome
temporally associated with COVID-19. Ottawa : Société canadienne de pédiatrie; 6 juillet 2020.
Accessible sur le site : https://www.cps.ca/fr/documents/position/SIME (consulté en février 2021).
Google Scholar
5. McCrindle BW, Rowley AH, Newburger JW, et coll. Diagnosis, treatment, and long-term management
of Kawasaki disease: a scientific statement for health professionals from the American Heart
Association. Circulation 2017;135(17):e927-e999.
6. Soma VL, Shust GF, Ratner AJ. Multisystem inflammatory syndrome in children. Curr Opin Pediatr.
1er février 2021; 33(1):152-158. doi: 10.1097/MOP.0000000000000974. PMID : 33278107.
7. Kabeerdoss, J., Pilania, R.K., Karkhele, R. et coll. Severe COVID-19, multisystem inflammatory syndrome
in children, and Kawasaki disease: immunological mechanisms, clinical manifestations and
management. Rheumatol Int 41, 19–32 (2021). https://doi.org/10.1007/s00296-020-04749-4
8. Henderson, L.A., Yeung, R.S.M. MIS-C: early lessons from immune profiling. Nat Rev Rheumatol 17,
75–76 (2021). https://doi.org/10.1038/s41584-020-00566-y
9. Ahmed M, Advani S, Moreira A, et coll. Multisystem inflammatory syndrome in children: A systematic
review. EClinicalMedicine. 26 sept. 2020; 26:100527. doi: 10.1016/j.eclinm.2020.100527. Publication
en ligne le 4 sept. 2020. PMID : 32923992; PMCID: PMC7473262.9
10. Yeung RS, Ferguson PJ. Is multisystem inflammatory syndrome in children on the Kawasaki syndrome
spectrum? J Clin Invest. 2 nov. 2020; 130(11):5681-5684. doi: 10.1172/JCI141718.
PMID : 32730226; PMCID : PMC7598074.
11. Henderson LA, Canna SW, Friedman KG, et coll. American College of Rheumatology Clinical Guidance
for Multisystem Inflammatory Syndrome in Children Associated With SARS-CoV-2 and Hyperinflammation
in Pediatric COVID-19: Version 1. Arthritis Rheumatol. Nov. 2020; 72(11):1791-
1805. doi: 10.1002/art.41454. Publication en ligne le 3 octobre 2020. PMID : 32705809; PMCID :
PMC7405113.
12. Feldstein LR, Rose EB, Horwitz SM, et coll. Overcoming COVID-19 Investigators; CDC COVID-19
Response Team. Multisystem Inflammatory Syndrome in U.S. Children and Adolescents. N Engl J
Med. 23 juillet 2020; 383(4):334-346. doi: 10.1056/NEJMoa2021680. Publication en ligne le 29
juin 2020. PMID : 32598831; PMCID : PMC7346765.
13. Whittaker E, Bamford A, Kenny J, et coll. Clinical Characteristics of 58 Children With a Pediatric
Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. JAMA.
2020;324(3):259–269. doi:10.1001/jama.2020.10369
|




