Été 2021 (volume 31, numéro 2)
Un bref historique du traitement
de la polyarthrite rhumatoïde
Par Reza Mirza, M.D. (d’après une discussion avec le Dr Arthur Bookman)
Télécharger la version PDF
« L’une des maladies les plus réfractaires, les plus obstinées et les plus invalidantes qui puissent toucher le corps humain. »
– Lane et Griffiths, 1890
« Des cas de ruine et de désespoir, dans un sens, une maladie plus maligne que le cancer. »
– Spender, 1889
 
Dr Jacques Forestier Dr Henri Forestier
Années 20 :
« Tout ce qui est or ne brille pas. »
– J.R.R. Tolkien
En 1929, le Dr Jacques Forestier, fils
d’Henri Forestier, fondateur de la Ligue
internationale contre le rhumatisme, a
affirmé que la polyarthrite rhumatoïde
(PR) et la tuberculose (TB) partageaient
des caractéristiques similaires : maladie
fébrile avec leucocytose, anémie et
malaise général. Il a émis l’hypothèse
que l’or, utile dans le traitement de la
tuberculose, pourrait également être
utile pour traiter la PR.
Au cours des années qui ont suivi, il a publié un certain
nombre de séries de cas sur la chrysothérapie dans The Lancet.
Il a administré à des patients 250 mg de thiopropanol d’or par
voie intramusculaire (IM) toutes les semaines pendant 10 à 12
semaines, a attendu un mois et, dans certains cas, a administré
une autre série de traitements.
Cinq des 15 patients ont eu une « excellente » réponse, cinq
autres ont présenté une « très nette amélioration », deux ont eu
une « réponse minimale » et trois n’ont pas vu d’aggravation de
leur état. À titre de comparaison, nous citons généralement des
taux de réponse biologique de 20 % pour l’ACR70 et de 40 %
pour l’ACR50+ (je dis « plus », car les gens comme moi oublient
que l’ACR50 inclut l’ACR70).
La controverse sur l’efficacité de l’or s’est poursuivie jusqu’en
1945, lorsque Thomas Fraser a publié les résultats du tout premier
essai contrôlé à répartition aléatoire (ECRA) et à double insu portant sur un médicament antirhumatismal.
Dans cet essai, on comparait
l’or à un placebo. Il n’a pas eu la chance
de pouvoir utiliser le score CDAI (Clinical Disease Activity Index) ou le système
de notation de l’American College of
Rheumatology (ACR). Comme il l’a admis
lui-même : « Il est difficile de décider des
critères à utiliser. » Selon son impression,
42 % des patients ont connu une grande
amélioration.
Dans les années 80, des traitements
oraux à base d’or, plus pratiques mais
moins efficaces, ont été mis au point.
Mode d’action (de l’or) :
- Les patients traités par l’or présentent une diminution des
immunoglobulines, du facteur rhumatoïde et des complexes
immuns circulants.
- L’or peut dissocier les peptides antigéniques du complexe
majeur d’histocompatibilité de classe II (CMH II), diminuant
la présentation de l’antigène, ce qui a été démontré in vivo
pour l’allèle HLA-DRB1 (l’épitope partagé).
- L’or inhibe la production de prostaglandines E2.
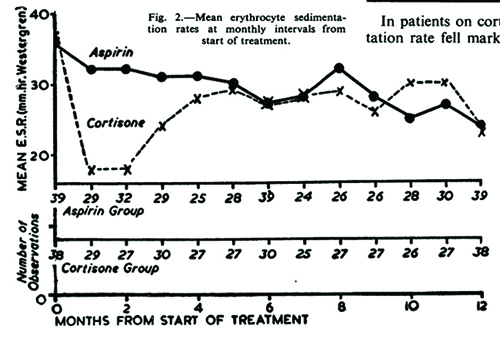
Années 40 et 50 : Rx : AAS à 325 mg 3 co QID
– Vous avez bien lu!
L’essai EMPIRE sur les maladies rhumatismales (1955) était l’essai
CYCLOPS de l’époque1. Cet essai a démontré que l’acide acétylsalicylique
(AAS) n’était pas différent de la cortisone sur le plan de
l’amélioration du nombre d’articulations touchées et de la vitesse
de sédimentation (VS), marquant ainsi le début d’une ère de prolifération
des anti-inflammatoires non stéroïdiens (AINS).
Années 50 : Cortisone
La première fois où les
médecins ont réalisé
qu’il existait peut-être
un agent capable de
produire une rémission
chez les patients
atteints de PR coïncide
avec le moment où ils
ont réalisé que les patients atteints de PR qui présentaient une
jaunisse se rétablissaient spontanément. La chasse à l’« impressionnant
antidote de la nature » était lancée : « Des volontaires
atteints de polyarthrite rhumatoïde ont reçu des sels biliaires
par voie orale, un dérivé d’un acide biliaire (la décholine) par
voie orale et intraveineuse, des extraits de foie par voie parentérale,
de la bile de boeuf par proctoclyse (par le rectum) et de
grandes quantités de bile humaine par sonde gastrique... » Rien
de tout cela n’a fonctionné!
Un autre indice est venu des femmes atteintes de PR qui ont
connu une amélioration spectaculaire pendant leur grossesse. Le
centre d’intérêt s’est alors déplacé vers les hormones. En 1948,
le Dr Kendall (un biochimiste qui a isolé la thyroxine et plusieurs
hormones surrénales, dont la cortisone) et le Dr Hench,
de la clinique Mayo, ont testé le « composé E » (cortisone) chez
un patient atteint de rhumatismes à une dose quotidienne de
100 mg par voie IM. Son état s’est amélioré de façon spectaculaire
en trois jours.
Cette découverte leur a valu le prix Nobel! Le Dr Laurence
Rubin insiste pour que vous lisiez leur discours d’acceptation du
prix Nobel sur leur découverte2. Il est très intéressant.
Les 60 années suivantes ont été marquées par le lancement
des médicaments que nous connaissons bien. Nous pouvons
donc nous contenter de brefs récits :
Années 60 : AINS. Le premier AINS a été l’ibuprofène (breveté
en 1962, commercialisé en 1969), et le deuxième, le naproxène
(breveté en 1967, commercialisé en 1976). À un certain moment,
on comptait 15 AINS sur le marché canadien. Les taux de crises
cardiaques ont grimpé en flèche. Les hospitalisations pour des
complications d’ulcères ont atteint des proportions épidémiques
Années 70 : Méthotrexate et cyclophosphamide. En 1972,
Rex Hoffmeister, un rhumatologue praticien de Spokane, dans l’État
de Washington, faisait état des effets positifs associés au MTX par
voie intramusculaire. Lors de la réunion de l’ACR, on s’est moqué de
lui. Il a fallu attendre les années 80 pour que la rigide communauté
des rhumatologues mène le premier essai à double insu.
Années 90 : Le léflunomide a été approuvé en 1998 aux États-
Unis, la même année que l’étanercept.
Conclusion À mes yeux, la rhumatologie est la spécialité qui a connu les
progrès les plus importants pour les patients au cours des dernières
décennies. Mes collègues et moi sommes impatients de
voir ce que nous réserve l’avenir. Seules quelques bêtes restent
à dompter : la sclérodermie, le syndrome de Sjögren, le loup à
plusieurs faces (LED) et les vascularites.
AAS entérosoluble
administré à doses
croissantes jusqu’à la
dose maximale tolérée.
La dose optimale
habituelle était de
975 mg QID (3,9 g 1 f.p.j.).
La dose était augmentée
jusqu’à ce que le patient
présente un acouphène,
puis diminuée. Ce n’était
pas le premier cas où
les rhumatologues
invoquaient une
telle règle.
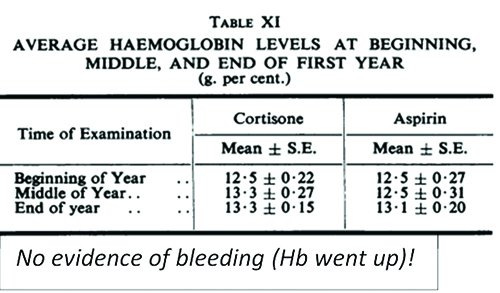
Dr Bookman: « Personne n’a eu d’IM
sous aspirine à haute dose. Nous
croyions que la maladie rhumatismale
protégeait des maladies coronariennes
jusqu’à ce que nous passions à
l’ibuprofène et au naproxène. »
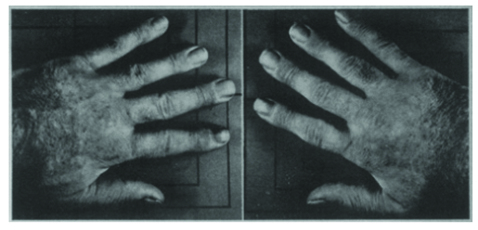
9e jour du
traitement par
l’AAS
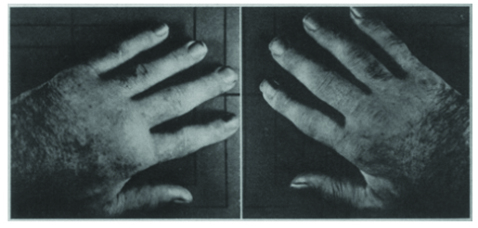
48 heures après
l’arrêt de l’AAS
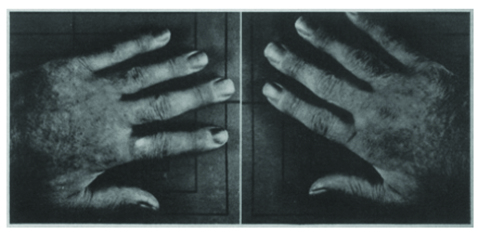
72 heures
après la reprise
de l’AAS
Le Toronto Wellesley Hospital (1963-1998),
un service de rhumatologie de 40 lits :
Une réflexion du Dr
Bookman
Les patients provenaient de tout l’Ontario, parfois de l’arrière
d’une grange, souvent complètement immobiles. Ils étaient hospitalisés pendant plusieurs semaines.
Ils étaient amenés à l’hôpital pour différentes raisons : traitements de physiothérapie, d’ergothérapie et de réadaptation,
gestion des médicaments, chirurgie reconstructive et pose
d’attelles et d’écharpes. Tous les jours, à midi, la physiothérapie
était prodiguée par l’interphone et les patients suivaient le traitement à partir de leur lit.
Il y avait une piscine thérapeutique chauffée. Les patients
immobiles étaient soulevés à l’aide d’une sorte de nacelle. Les
mains étaient trempées dans de la cire de paraffine chaude
(chauffée au bain-marie) pour soulager la raideur matinale
avant la physiothérapie des mains
Tous les jours, les stagiaires en rhumatologie procédaient à
plusieurs injections intra-articulaires à la fois chez les patients.
Les seuls médicaments à la disposition des médecins étaient
l’or, les AINS, la cortisone et la chloroquine. La chloroquine
était beaucoup plus efficace que l’hydroxychloroquine, mais
elle était associée à des taux plus élevés de toxicité rétinienne et
provoquait une toxicité cornéenne altérant la vision nocturne.
Références :
1. de Groot, K, et coll. “Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic
antibody-associated vasculitis: a randomized trial.” Annals of internal medicine. 2009; 150(10): 670-680.
2. Kendall, E. C. The development of cortisone as a therapeutic agent. Antibiot Chemother (Northfield). 1951; 1(1):
7-15.
Reza Mirza, M.D., stagiaire en rhumatologie,
Université de Toronto, Toronto (Ontario)
|
