Automne 2019 (Volume 29, numéro 3)
Évaluation des modèles de pratique canadiens quant à l'aortite idiopathique :une étude qualitative
By Edsel Ing, MD, FRCSC, MPH; Qinyuan (Alis) Xu, BSc; and Philip Baer, MDCM, FRCPC, FACR
Télécharger la version PDF
Résumé
Contexte – L’aortite idiopathique (AI) et l’aortite isolée (Ais) sont des affections mal définies. Le but de cette étude était de
déterminer la pratique actuelle chez les rhumatologues canadiens pour traiter ces affections.
Méthodes – En juin 2016, un sondage en ligne a été mené auprès de membres de la Société canadienne de rhumatologie
(SCR) au moyen de la plate-forme FluidSurveys™ (www.fluidsurveys.com).
Résultats – Soixante-huit des 420 membres de la SCR (16 %) ont répondu au sondage et 60 de ces 68 membres (88 %)
l’ont rempli. La majorité des participants étaient des rhumatologues universitaires (69 %); la plupart (60 %) ont déclaré voir
un cas d’AI ou moins par année, tandis que 23 % (15/66) n’avaient jamais vu de cas. Douze participants (26 %) ont déclaré
faire une distinction entre l’AI et l’AIs; 9/12 (75 %) estimaient que l’exclusion des anomalies radiographiques des vaisseaux
des branches aortiques était importante pour définir l’AIs. La majorité des répondants procédaient à des évaluations
cliniques et biochimiques approfondies, mais seulement 38 % d’entre eux effectuaient systématiquement une imagerie
complète des branches aortiques thoraciques et abdominales. L’approche de prise en charge était variable. Les participants
étaient plus susceptibles de traiter (par des corticostéroïdes) l’aortite touchant les vaisseaux des branches aortiques
comparativement à l’AIs. En présence d’un patient asymptomatique présentant des marqueurs inflammatoires normaux,
les participants étaient plus susceptibles de traiter une aortite confirmée histologiquement et associée aux vaisseaux
des branches aortiques (61 %); les taux de traitement étaient de 23 % et 26 % (respectivement) pour l’AIs diagnostiquée
histologiquement et radiographiquement, et de 30 % pour l’aortite diagnostiquée radiographiquement associée aux
vaisseaux des branches aortiques. Seuls 2 des 38 répondants se sentaient « parfaitement à l’aise » dans la prise en charge
des patients atteints de ces affections, et tous sauf 1 estimaient que des recommandations seraient bénéfiques.
Interprétation – L’AI est une affection rare, ce qui entraîne un manque de connaissances et une grande variabilité dans les
pratiques. D’autres recherches sont nécessaires pour combler les lacunes dans les connaissances et favoriser l’élaboration
de recommandations éclairées.
Introduction
L’aortite est un terme général utilisé pour décrire les troubles
caractérisés par une inflammation de l’aorte1. L’aortite peut être
d’origine infectieuse ou causée par diverses affections inflammatoires systémiques1. Les causes infectieuses comprennent
les bactéries Salmonella, Staphylococcus, Streptococcus pneumonia,
Treponema pallidum et Mycobacterium tuberculosis1. Les affections
inflammatoires systémiques associées à l’aortite comprennent
l’artérite à cellules géantes (ACG), l’artérite de Takayasu, la maladie de Behçet, le syndrome de Cogan, la granulomatose avec
polyangéite, la maladie de Kawasaki, la polyartérite noueuse,
la pseudo-polyarthrite rhizomélique, polychondrite récidivante,
la polyarthrite rhumatoïde, la sarcoïdose, le syndrome de Sjögren,
les spondylarthropathies associées à l’antigène HLA-B27 et le
lupus érythémateux disséminé1. L’aortite est parfois diagnostiquée chez des patients qui ne présentent aucun signe de maladie
systémique ou d’étiologie infectieuse; c’est ce qu’on appelle généralement l’aortite idiopathique (AI). Chez la plupart des patients,
cette forme d’aortite est diagnostiquée radiologiquement, le plus
souvent par tomodensitométrie (CT) ou par imagerie par résonance magnétique (IRM). De plus, un nombre croissant de cas
sont diagnostiqués lorsque l’examen pathologique d’échantillons
chirurgicaux provenant d’anévrismes aortiques réséqués montre
des caractéristiques d’aortite2-4.
L’AI n’est pas une affection bien définie. Il n’existe aucun critère
pathologique ou clinique spécifique permettant sa classification
ou son diagnostic, à l’exception de la présence d’une inflammation de l’aorte et de l’absence de caractéristiques cliniques d’un
autre trouble systémique, comme ceux décrits ci-dessus. Nos
connaissances actuelles sur l’AI proviennent principalement
d’études rétrospectives chez des patients atteints d’une aortite
diagnostiquée pathologiquement2-6, y compris une récente série
de 47 cas d’aortite dans notre établissement, dont 32 étaient
considérés comme une AI6.
L’expression « aortite isolée » (AIs) désigne
une forme précise d’AI dont la pathologie
se limite à l’aorte et n’est pas associée aux
vaisseaux des branches aortiques. Les termes
« aortite idiopathique » et « aortite isolée »
sont souvent utilisés de façon interchangeable dans la littérature publiée, et peu de
rapports de cas publiés fournissent des résultats d’imagerie au-delà de la zone concernée pour permettre une caractérisation précise. Le terme « aortite isolée » a été ajouté
à la nomenclature des vascularites 2012 du
groupe Chapel Hill Consensus Conference8,
dans la catégorie « Single-organ vasculitis »
(vascularite touchant à un seul organe),
mais la nomenclature du groupe ne propose
aucune définition précise de cette affection.
À l’heure actuelle, il n’existe pas de lignes
directrices pour orienter le bilan initial, le
traitement et la surveillance subséquente
des patients atteints d’AI ou d’AIs, ce qui
entraîne une grande variabilité d’un cas à
l’autre. Il existe un grand besoin d’études
systématiques sur l’aortite idiopathique et
l’aortite isolée, dans le but ultime d’élaborer
des lignes directrices permettant de normaliser la prise en charge des patients atteints
de ces affections. Le but de cette étude
était de déterminer les modèles de pratique
actuels des rhumatologues canadiens auprès
des patients atteints d’AI et d’AIs.
Méthodologie : conception et
administration du sondage
En juin 2016, un sondage en ligne a été mené auprès de membres
de la Société canadienne de rhumatologie (SCR) au moyen de la
plate-forme FluidSurveys™ (www.fluidsurveys.com).
L’étude consistait en un sondage mené
auprès des membres de la SCR au moyen
de la plate-forme en ligne FluidSurveysTM
(www.fluidsurveys.com) entre le 13 juin 2016
et le 24 juin 2016. Le sondage a été élaboré
par les chercheurs en consultation avec des
membres principaux du réseau CanVasc
(Canadian Vasculitis Network). Le sondage a
été conçu pour évaluer comment les rhumatologues canadiens définissent, diagnostiquent, surveillent et traitent les patients
atteints d’AI et d’AIs. Une copie du sondage est disponible dans les documents
supplémentaires du numéro en ligne de ce
manuscrit (hyperlien vers le document PDF).
Avant sa distribution, le sondage a fait l’objet
d’un projet pilote auprès d’un petit groupe
(n = 4) de rhumatologues de notre établissement, qui ont fourni des commentaires supplémentaires et approuvé la version finale
Le Comité des communications de la SCR a
envoyé aux membres de la SCR une invitation
par courriel avec un lien vers le sondage, qui était offert en français et en anglais. En répondant au sondage,
les participants donnaient implicitement leur consentement, et
leur participation était anonyme. Les participants avaient deux
semaines pour répondre au sondage; deux courriels de rappel ont
été envoyés, au jour 7 et le dernier jour du sondage.
Analyse du sondage
Les données ont été extraites par le logiciel FluidSurveys™ et
le logiciel Microsoft Excel (version 2010) a été utilisé pour l’analyse descriptive. L’approbation sur le plan déontologique a été
obtenue par l’entremise de l’Institut de recherche de l’Hôpital
d’Ottawa (protocole no
4473 de l’IRHO-RED).
Résultats
Soixante-quatorze des 420 membres (18 %) de la SCR ont répondu, 68 (16 %) ont répondu au sondage et 60 de ces 68 membres
(88 %) l’ont terminé.
Caractéristiques démographiques
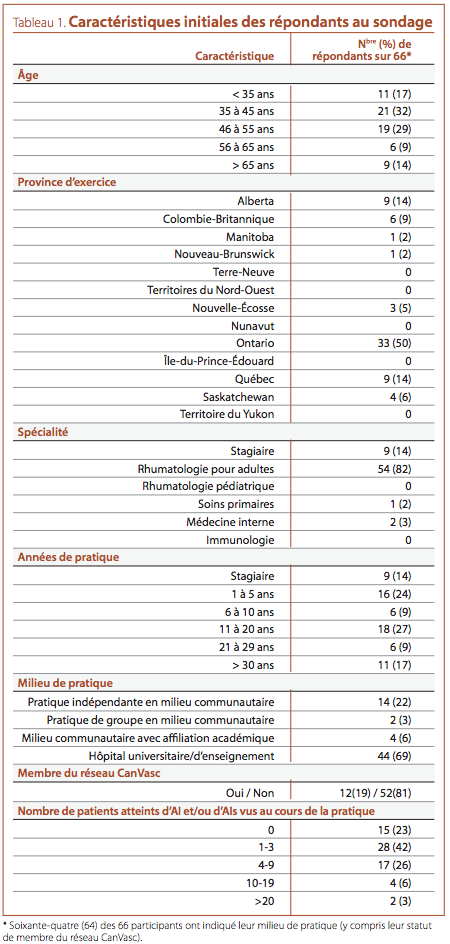
Les caractéristiques initiales des répondants sont présentées dans
le Tableau 1. La majorité des participants étaient des rhumatologues pour adultes (54/66, 82 %) âgés de 35 à 55 ans (40/66,
61 %), exerçant dans un établissement d’enseignement (44/64,
69 %); la moitié des répondants (33/66) étaient établis en
Ontario. Douze participants (19 %) étaient des membres principaux ou associés du réseau CanVasc. Quinze des 66 participants
(23 %) ont déclaré n’avoir jamais vu un patient atteint d’AI ou
d’AIs au cours de leur pratique (Tableau 1); ces sujets n’ont pas
répondu aux parties suivantes du sondage.
Définitions
Presque tous les participants (46/47) estimaient qu’il fallait
exclure une affection inflammatoire systémique définie pour
définir l’AI. De plus, près de la moitié des participants (20/44)
estimaient qu’il fallait également exclure les anomalies radiographiques touchant les vaisseaux des branches aortiques. La majorité des participants (39/45, 87 %) ont déclaré que les marqueurs
inflammatoires n’étaient pas pertinents dans le diagnostic de
l’aortite idiopathique
Douze des 47 participants (26 %) ont déclaré faire une distinction entre l’AI et l’AIs. Parmi ces participants, la plupart considéraient que l’exclusion d’une affection inflammatoire systémique
définie (10/12, 83 %) et d’anomalies radiographiques dans les
vaisseaux des branches aortiques (9/12, 75 %) était nécessaire
pour définir l’AIs, et 9/12 (75 %) estimaient que les marqueurs
inflammatoires étaient sans pertinence pour cette définition.
Références
La chirurgie vasculaire ou cardiaque a été la source d’orientation
la plus courante chez les patients atteints d’AI et d’AIs, des patients ayant été aiguillés vers 40/46 des participants (87 %). La
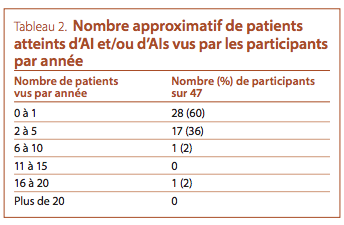
majorité des participants voient un ou ne voient aucun nouveau
patient atteint d’AI ou d’AIs par année (voir le Tableau 2). La raison la plus fréquente de l’aiguillage était la découverte fortuite
d’une anomalie vasculaire suggérant une aortite lors d’un examen
d’imagerie (39/47, 83 %) et la découverte d’une pathologie positive pour une aortite après un anévrisme ou une réparation de la
valvule aortique (34/47, 72 %). Les raisons les moins courantes
de l’aiguillage étaient la découverte d’un anévrisme de l’aorte
thoracique chez un patient présentant des symptômes ou des
signes systémiques ou d’autres caractéristiques d’une affection
inflammatoire systémique (23/47, 49 %) et la découverte d’un
anévrisme de l’aorte thoracique chez un patient ayant déjà présenté une affection inflammatoire générale systémique associée à
une aortite (13/47, 28 %).
Bilan initial
Quarante-cinq participants ont répondu à des questions concernant le bilan initial des patients atteints d’AI; 13/45 (29 %) ont déclaré qu’ils étaient le médecin expert référent pour la vascularite
dans leur centre (huit étaient membres du réseau CanVasc). Lors de
l’évaluation des patients soupçonnés d’être atteints d’AI ou d’AIs, la
plupart des participants ont affirmé dépister « systématiquement »
les symptômes ou signes suggérant une atteinte des vaisseaux des
branches aortiques (41/45, 91 %), les symptômes ou signes d’une
affection inflammatoire générale définie (41/45, 91 %), et les symptômes et signes d’infection (38/45, 84 %). En ce qui concerne les
examens de laboratoire, les 45 répondants ont tous déclaré qu’ils
effectuaient régulièrement des hémogrammes complets ainsi que
des tests de la fonction rénale et de la protéine C-réactive (PCR).
Toutefois, les tests systématiques visant à exclure la tuberculose et
la syphilis étaient moins fréquents et ont été signalés par 19 (42 %)
et 35 (78 %) participants, respectivement. Dix-sept participants
(38 %) ont déclaré avoir réalisé une imagerie transversale (TDM ou
IRM) systématique de l’arbre aortique entier et de ses principales
branches thoraciques et abdominales.
Traitement
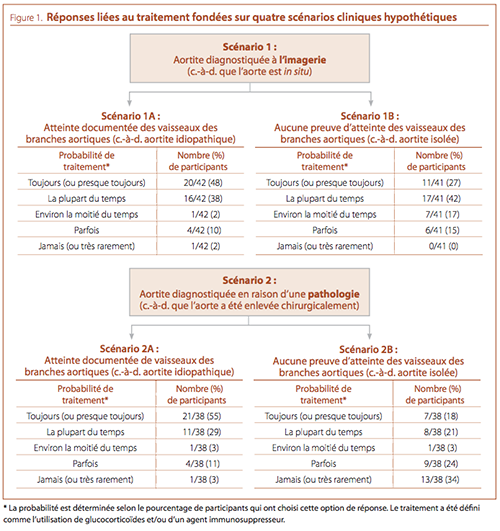
On a demandé aux participants d’indiquer leur approche thérapeutique pour quatre scénarios cliniques hypothétiques (voir la
Figure 1) : aortite diagnostiquée par imagerie avec et sans atteinte
des vaisseaux des branches aortiques (scénarios 1A et 1B, respectivement) et aortite diagnostiquée en raison d’une pathologie
(la zone concernée de l’aorte ayant été enlevée par chirurgie) avec
et sans atteinte des vaisseaux des branches aortiques (scénarios
2A et 2B, respectivement). Quel que soit le mode de diagnostic,
les participants étaient plus susceptibles de traiter (à l’aide de corticostéroïdes) l’aortite avec atteinte des vaisseaux des branches
aortiques. Les participants étaient moins susceptibles de traiter
une aortite isolée par ablation chirurgicale de l’aorte en cause
(scénario 2B), plus d’un tiers des participants n’ayant « jamais »
traité ce type de patient. Fait important, nous n’avons pas constaté
de différences signifi catives dans les approches de traitement des
participants selon le type de pratique, y compris la pratique dans
un centre spécialisé en vascularite.
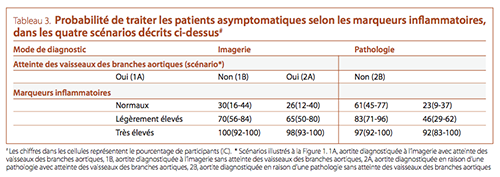
Pour chacun des scénarios cliniques, on a ensuite demandé
aux participants s’ils traiteraient (avec des corticostéroïdes) des
patients asymptomatiques selon différents niveaux de réponse
infl ammatoire systémique (évalués par des marqueurs infl ammatoires, la vitesse de sédimentation [VS] et la PCR (Tableau 3). La
plupart des participants ont indiqué qu’ils traiteraient les patients asymptomatiques présentant des marqueurs infl ammatoires
signifi cativement élevés, quel que soit le scénario clinique. Dans le contexte de marqueurs inflammatoires normaux ou légèrement
élevés, les participants étaient plus susceptibles de traiter l’aortite
diagnostiquée en raison d’une pathologie en présence de lésions
aortiques et/ou de lésions des vaisseaux des branches aortiques
(scénario 2A).
Suivi et contrôle
La plupart des répondants ont réévalué leurs patients atteints d’AI
tous les trois mois au cours des deux premières années suivant le
diagnostic (27/38, 71 %). Plus des trois quarts des répondants
assuraient un suivi en effectuant un hémogramme complet et en
évaluant le taux de créatinine, la VS et la PCR à chaque visite. De
plus, la majorité des participants réalisaient une angiographie par
TDM ou par IRM tous les 6 à 12 mois (28/35, 80 %). Fait à noter,
quatre répondants (11 %) ont déclaré n’avoir jamais commandé
d’imagerie de suivi pour les patients atteints d’AI chez qui l’atteinte des vaisseaux des branches aortiques a été documentée par
radiographie au départ. Les approches de surveillance n’ont pas
été différentes pour l’aortite diagnostiquée par imagerie ou en
raison d’une pathologie.
Lorsqu’on leur a demandé dans quelle mesure les participants étaient à l’aise dans la prise en charge des patients atteints
d’AI ou d’AIs, la majorité d’entre eux ont répondu qu’ils étaient
« plutôt mal à l’aise » 17/38 (45 %), 14/38 (37 %) d’entre eux ont
répondu qu’ils étaient « raisonnablement à l’aise » et 5/38 (13 %)
d’entre eux ont répondu qu’ils étaient « très mal à l’aise »; deux
participants (5 %) se sont dits « parfaitement à l’aise » dans la prise
en charge de ces patients. Trente-six des 37 participants (97 %)
étaient d’avis que l’élaboration de recommandations pour la prise
en charge des patients atteints d’AI ou d’AIs serait utile.
Interprétation
Les rhumatologues canadiens ne connaissent pas bien l’AI et l’AIs,
et près du quart des participants ont déclaré n’avoir jamais vu
un seul patient atteint de ces affections dans leur pratique. La
majorité des participants ont déclaré avoir vu un cas ou n’avoir vu
aucun cas par année. Seul un faible pourcentage de participants
(5 %) ont déclaré être « parfaitement à l’aise » dans la prise en
charge des patients atteints d’AI ou d’AIs. En raison du volume
insuffisant de patients atteints d’AI et de l’absence de lignes directrices cliniques, une grande variabilité a été observée dans cette
étude en ce qui concerne divers aspects de la prise en charge de
cette affection.
Seulement un quart des participants ont dit faire une distinction entre l’AI et l’AIs. Ce chiffre n’est pas surprenant, étant
donné que les deux termes sont souvent utilisés de façon interchangeable dans la littérature publiée1-2,4,9. Une AI est envisagée lorsque l’aortite est observée en l’absence de caractéristiques cliniques suffisantes pour diagnostiquer une affection
systémique sous-jacente, le plus souvent une ACG. L’AIs est un
sous-type spécifique d’AI qui se limite à l’aorte. Une imagerie
complète des vaisseaux des branches aortiques serait nécessaire pour exclure que les vaisseaux des branches sont touchés
et permettre un diagnostic d’AIs; fait rassurant, les trois quarts
des participants qui ont fait la distinction entre l’AI et l’AIs
ont indiqué que l’exclusion des anomalies radiographiques des
vaisseaux des branches aortiques est importante pour définir
l’AIs. Bien que la classification de l’AIs comme une « vascularite
touchant un seul organe » dans la nomenclature de Chapel Hill
suggère qu’un degré significatif d’inflammation systémique ne
devrait pas être associé à cette affection, ce n’est pas le cas
selon notre expérience6, l’expérience des participants à cette
étude (75 % ont estimé que les taux de marqueurs inflammatoires étaient non pertinents pour définir l’AIs) et dans la
littérature publiée5.
La majorité des répondants ont procédé à des évaluations
cliniques et biochimiques approfondies chez les patients atteints
d’AI et d’AIs. Cependant, seuls 38 % ont réalisé une imagerie
complète des vaisseaux des branches aortiques thoraciques et
abdominales. Dans la série de cas sur l’AI de la Clinique Mayo2,
la majorité des patients (89 %) ont subi une imagerie vasculaire
supplémentaire (c.-à-d. une tomodensitométrie et une angiographie par RM). D’autres anomalies vasculaires étaient fréquentes
et présentes chez 72 % des patients ayant subi un examen par
imagerie. Dans la série de cas à notre centre publiée récemment,
21 des 32 patients (66 %) ayant reçu un diagnostic d’AI ont subi
une imagerie complète des vaisseaux des branches aortiques
au début de l’étude6; 15 (71 %) d’entre eux présentaient des
lésions des vaisseaux des branches aortiques, alors que 3 (14 %)
présentaient des lésions supplémentaires à l’aorte. À notre avis, étant donné la prévalence élevée de lésions vasculaires supplémentaires, l’imagerie de l’arbre aortique entier et de ses branches
devrait faire partie intégrante du bilan initial.
Il n’existe actuellement aucune approche normalisée de traitement médical à la suite d’un diagnostic d’AI, ce qui entraîne une
grande incertitude. Les taux signalés d’utilisation de corticostéroïdes pour le traitement de l’AI varient de 9 % à 38 % dans la documentation publiée2-4,6-7. De plus, on manque d’information sur
la façon d’orienter le traitement dans des scénarios cliniques précis, comme la présence d’une maladie des vaisseaux des branches
aortiques ou en fonction du niveau de réponse inflammatoire.
Comme on pouvait s’y attendre, les rhumatologues canadiens sont
plus susceptibles de traiter des maladies comportant une atteinte
confirmée par radiographie plus importante ou des niveaux élevés
d’inflammation systémique. Fait intéressant, en présence d’un patient asymptomatique présentant des marqueurs inflammatoires
normaux, les participants semblent plus susceptibles de traiter
en présence d’anomalies des vaisseaux des branches aortiques et
après un diagnostic histologique plutôt que radiographique de
l’aortite. Ceci indique probablement qu’il existe un consensus
relativement plus large sur la définition histologique de l’aortite9
par rapport à la définition radiographique, cette dernière faisant
l’objet d’une controverse importante10.
Une faiblesse importante de notre étude est le faible taux de
réponse, qui était de 18 %. Selon la SCR, le taux de réponse typique
aux sondages de cette nature est de 20 à 30 %. Nous soupçonnons
que ce taux de réponse inférieur à la moyenne reflète la rareté de
l’aortite idiopathique, ce qui fait que de nombreux membres de
la SCR n’ont pas participé au sondage en raison de son manque
d’applicabilité à leur pratique individuelle. Cette théorie est
étayée par la surreprésentation importante des rhumatologues
universitaires dont la pratique se déroule principalement dans un
hôpital d’enseignement (69 % de tous les participants, 55 % si
l’on exclut les stagiaires), où les patients atteints de maladies rares
comme l’AI sont plus susceptibles d’être aiguillés; le pourcentage
des rhumatologues canadiens exerçant en milieu universitaire est
estimé à 40 % selon une enquête nationale publiée récemment11.
Le ciblage des membres de la SCR a probablement contribué à
la surreprésentation des rhumatologues universitaires dans notre
étude, car ils sont plus susceptibles d’être membres de la SCR
que ceux qui exercent seuls dans un milieu communautaire11.
D’autres biais de sélection ont probablement été introduits par
la probabilité plus élevée de réponse de la part de rhumatologues connaissant personnellement les chercheurs de cette étude;
ceci est démontré par la surreprésentation des rhumatologues de
l’Ontario dans cette étude (50 %) comparativement aux estimations nationales établies à 38%11. Le faible taux de réponse et la
surreprésentation des rhumatologues universitaires limitent la
généralisation de nos résultats à l’ensemble de la communauté des
rhumatologues canadiens. Cependant, nos résultats représentent
le point de vue du groupe de rhumatologues qui possèdent le
plus d’expérience relativement à l’AI et dont les opinions seront
donc plus utiles pour formuler de futures recommandations
visant à guider la prise en charge de ces affections. La subjectivité
des chercheurs dans le cadre de l’élaboration du sondage est une
autre faiblesse potentielle de cette étude. En tant que chercheurs
de l’étude, nous avons conçu le sondage en nous basant sur notre
expérience et nos connaissances personnelles concernant l’aortite. Les questions spécifiques et les options de réponse proposées
ont probablement biaisé les réponses des participants en faveur
de notre point de vue (celui des chercheurs). Dans le but de minimiser cette subjectivité, le sondage a été révisé et modifié par les
membres principaux du réseau CanVasc et mis à l’essai auprès
d’un petit groupe de rhumatologues avant sa diffusion.
En conclusion, on observe une grande variabilité chez les
rhumatologues canadiens en ce qui concerne les définitions, le
bilan, le traitement et la surveillance des patients atteints d’IA et
d’AIs. Les membres de la SCR font part d’une incertitude dans la
prise en charge de ces patients, ce qui témoigne du besoin important à l’égard de recommandations pour orienter les décisions.
D’après notre analyse de la documentation, cette étude est le premier rapport à évaluer les modèles de pratique des rhumatologues
canadiens (ou de tout groupe de rhumatologues, car aucune étude
semblable n’a été publiée sur l’AI) dans le domaine de l’arthrite
idiopathique. D’autres recherches de grande qualité (plus systématiques et/ou prospectives) devraient être la première étape pour
clarifier l’approche à adopter relativement à l’AI, ce qui permettrait
en fin de compte d’élaborer ces lignes directrices essentielles.
Références :
1. Gornik HL, Creager MA. Aortitis. Circulation 2008; 117:3039-51.
2. Liang KP, Chowdhary VR, Michet CJ, et coll. Noninfectious ascending aortitis: a case
series of 64 patients. J Rheumatol 2009; 36:2290-7.
3. Rojo-Leyva F, Ratliff NB, Cosgrove DM 3rd, Hoffman GS. Study of 52 patients with
idiopathic aortitis from a cohort of 1,204 surgical cases. Arthritis Rheum 2000;
43:901-7.
4. Miller DV, Isotalo PA, Weyand CM, et coll. Surgical pathology of noninfectious ascending aortitis: a study of 45 cases with emphasis on an isolated variant. Am J Surg Path
2006; 30:1150-8.
5. Merkel PA. Noninfectious ascending aortitis: staying ahead of the curve. J Rheumatol
2009; 36:2137-40.
6. Murzin DL, Belanger EC, Veinot JP, Milman N. A case series of surgically diagnosed
idiopathic aortitis in a Canadian centre: a retrospective study. CMAJ 2017; 5:483-7.
7. Clifford A, Arafat A, Idrees J, et coll. Aortitis: Outcomes from a cohort of 196 patients [abstract]. American College of Rheumatology Annual Meeting. Boston. Arthritis
Rheum 2014; 66:S1216-7.
8. Jennette JC, Falk RJ, Bacon PA, et coll. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65:1-11.
9. Stone JR, Bruneval P, Angelini A, et coll. Consensus statement on surgical pathology
of the aorta from the Society of Cardiovascular Pathology and the Association for European Cardiovascular Pathology: 1. Inflammatory diseases. Cardiovasc Pathol 2015;
24:267-78.
10. Cinar I, Wang H, Stone JR. Clinically isolated aortitis: pitfalls, progress and possibilities. Cardiovasc Pathol 2017; 29:23-32.
11. Barber CE, Jewett L, Badley EM, et coll. Stand up and be counted: measuring and
mapping the rheumatology workforce in Canada. J Rheumatol 2017; 44:248-57.
Marissa Keenan, M.D., M. Sc.
Boursière en rhumatologie,
Département de rhumatologie, L'Hôpital d'Ottawa
Ottawa (Ontario)
NNataliya Milman, M.D., FRCPC, M. Sc.
Rhumatologue,
Département de rhumatologie, L'Hôpital d'Ottawa
Ottawa (Ontario)
Le groupe de recherche Canadien sur les vascularites (CanVasc)
|




