Printemps 2014 (volume 24, numéro 1)
L’arthrite rhumatoïde et le zona
par Gordon Dow, M.D., FRCPC
Télécharger le PDF
Une femme âgée de 63 ans, atteinte depuis 12 ans de polyarthrite rhumatoïde (PR) séropositive traitée par le méthotrexate (MTX) par voie orale à 20 mg par semaine et par la prednisone à 7,5 mg à 10 mg par jour, consulte un médecin à cause d’une soudaine douleur exquise ressentie au côté gauche du front alors qu’elle se préparait à s’injecter un inhibiteur du facteur de nécrose tumorale (TNF). L’analgésique prescrit à la clinique sans rendez-vous se révèle inefficace et quatre jours après l’apparition de la douleur, la patiente constate la présence d’un érythème et de multiples vésicules sur le côté gauche du nez et du front. Vingt-quatre heures après l’apparition de ces lésions cutanées, la patiente se présente à son rendez-vous de suivi usuel chez son rhumatologue.
Au moins 90 % des adultes au Canada ont été atteints de l’infection par le virus de la varicelle et du zona (VZV) pendant leur enfance et ils sont donc à risque accru d’être atteints de l’herpès zoster, ou zona, causé par la réactivation du virus présent à l’état de latence dans les ganglions des nerfs sensoriels crâniens et de la racine dorsale. Chez l’adulte, le risque à vie d’être atteint du zona est de 20 à 30 %; au Canada, le taux d’incidence est d’environ 130 000 cas par année1. Le risque s’accroît avec le vieillissement, un trauma local, le stress psychologique, les troubles immunosuppresseurs et les médicaments immunosuppresseurs. Le zona est une préoccupation importante pour les patients atteints de PR et pour leurs soignants à cause de la grave invalidité qu’entraînent la névrite aiguë et la névralgie postherpétique (NPH). La NPH est la séquelle la plus notoire du zona. On la définit en général comme la persistance de la douleur durant plus de quatre semaines suivant la résolution des lésions cutanées, mais cette définition est arbitraire et elle varie selon les études. La NPH est rare chez les personnes de moins de 60 ans et sa fréquence n’est pas plus élevée chez l’hôte immunodéprimé. L’incidence de la NPH serait moins grande chez les personnes traitées par des inhibiteurs du TNF2.
Un risque plus élevé de zona chez les patients atteints de PR?
Plusieurs études de population récentes3-8 menées auprès de patients atteints de PR ont montré que le taux d’incidence brute du zona était d’environ 10 cas pour 1 000 années-patients. Cela correspond au double du risque observé dans la population non atteinte de PR après la correction pour tenir compte de l’âge4. Ce risque accru n’est pas simplement attribuable au traitement par les antirhumatismaux qui modifient l’évolution de la maladie (ARMM) immunosuppresseurs. En effet, on a observé un taux d’incidence de 8 pour 1 000 années-patients chez des patients atteints de PR ne recevant qu’un traitement de faible intensité, comparativement à des taux de 11,2 et de 10,6 pour 1 000 années-patients chez d’autres patients traités en vue de maîtriser une PR de modérée à grave, respectivement6. Le risque de zona dans la population générale est de 3 à 4 cas pour 1 000 années-patients4,9. Ces données donnent à penser que la dysrégulation immunitaire causée par la PR elle-même est reliée à un accroissement du risque de zona.
Quels médicaments immunosuppresseurs accroissent le risque de zona?
Le traitement par les corticostéroïdes (CS) est indéniablement relié à la réactivation du VZV, et ce, de manière proportionnelle à la dose. Par contre, l’effet du traitement par les ARMM est moins certain, ce qui s’explique en partie par le facteur de confusion du traitement concomitant par les CS dans les études de cohorte de grande envergure. Une étude cas-témoins emboîtés4 a montré que les CS pour la voie orale affichaient le rapport de cotes de risque (RC) corrigé le plus élevé (2,51), tandis que le RC pour les ARMM biologiques était semblable à celui des ARMM classiques (1,54 vs 1,37). Le risque de zona était semblable, peu importe si le CS était administré en monothérapie ou en association avec un ARMM. Un accroissement significatif du risque de zona a été documenté dans le traitement par la cyclophosphamide, l’azathioprine, la prednisone, le léflunomide et les anti-inflammatoires non stéroïdiens (AINS) sélectifs de la COX-2, mais non dans le traitement par le MTX ou par les ARMM biologiques3.
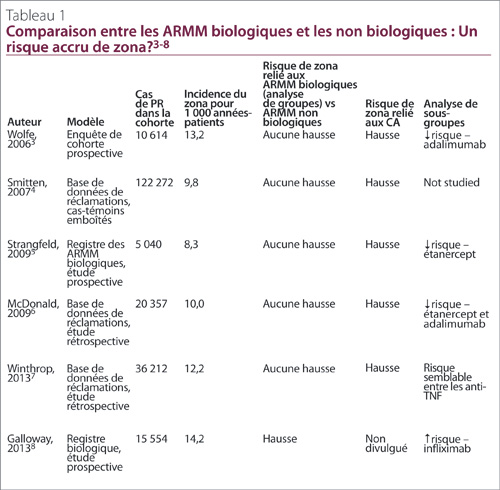
Pour l’heure, on ne sait pas avec certitude si le traitement par les ARMM biologiques accroît le risque de zona, comparativement aux ARMM classiques (Tableau 1). Une seule étude8 a mis en évidence un risque accru relié aux inhibiteurs du TNF lorsque les agents de cette classe sont évalués en association. Cette étude8 comportait d’importantes lacunes méthodologiques, notamment l’autodéclaration des patients dans la recherche de cas, ainsi que le recrutement de patients de cliniques hospitalières pour former la cohorte traitée par des ARMM biologiques, comparativement à des cliniques communautaires pour recruter les sujets témoins. Les analyses de sous-groupes de plusieurs études ont par ailleurs montré un risque accru relié à des ARMM biologiques en particulier, notamment l’infliximab (voir le Tableau 1). À ce jour, le poids de la preuve montre que le risque de zona ne diffère pas vraiment entre les ARMM biologiques et les ARMM classiques, et que la menace vient plutôt du traitement par les CS.
Devrait-on vacciner les patients atteints de PR contre le zona?
On ne connaît pas l’efficacité du vaccin contre le zona chez les patients atteints de PR parce que les personnes immuno-déprimées étaient exclues des deux plus grandes études d’observation10,11 menées avec ce vaccin. Dans ces deux études10,11, la vaccination a réduit le risque de zona de 51 % (3,3 % vs 1,6 %)10 chez les adultes en santé âgés de plus de 60 ans, et de 70 % (0,88 % vs 0,27 %) chez les adultes âgés de 50 à 59 ans11. L’étude Shingles Prevention Study (SPS)10 a montré que le vaccin a été bien toléré et qu’il a entraîné des manifestations indésirables au point d’injection chez 48 % des sujets vaccinés, comparativement à 16 % des sujets ayant reçu le placebo.
Les résultats de l’étude SPS10 révèlent également une réduction de 67 % de la fréquence de la NPH (0,1 % vs 0,4 %). D’après cette étude10, il fallait vacciner 59 patients pour prévenir un seul cas de zona sur trois ans, et il fallait en vacciner 364 pour prévenir un seul cas de NPH. Le suivi de plus longue durée d’un sous-groupe de patients de l’étude SPS nous apprend que l’écart significativement statistique de l’effet protecteur contre la NPH avait disparu après la troisième année suivant la vaccination et après la sixième année dans le cas de la protection contre le zona12. Au cours d’une étude de cohorte rétrospective récente13, on a examiné 463 541 dossiers de prestataires de Medicare (régime d’assurance maladie) atteints d’une maladie d’étiologie immunitaire. Les résultats montrent une réduction de
40 % de la fréquence du zona (rapport des risques instantanés [RRI] 0,61; intervalle de confiance [IC] à 95 % : 0,52 à 0,71) sur deux ans, ce qui donne à penser que le vaccin est efficace chez des sujets immunodéprimés. Parmi les obstacles à la vaccination, on note le coût du vaccin (environ
200 $), les pénuries récentes et l’efficacité modeste du vaccin; en outre, le vaccin doit être congelé pour la conservation et le transport. Étant donné que le risque de zona est deux à trois fois plus élevé dans la population atteinte de PR, que cette infection entraîne un important risque d’invalidité et qu’elle semble sensible au vaccin, on devrait proposer la vaccination aux personnes atteintes de PR âgées de 50 ans ou plus après avoir discuté avec elles des avantages et des inconvénients.
Devrait-on vacciner les patients ayant un antécédent de zona?
Dans les essais cliniques avec le vaccin, on a admis des patients sans égard à la présence ou à l’absence d’un antécédent de zona. Une étude récente14 a montré que la vaccination contre le zona ne conférait aucun bienfait additionnel chez des personnes ayant un antécédent documenté de zona au cours des deux années précédentes, ce qui permet de croire que l’infection naturelle stimule l’immunité cellulaire contre le VZV.
Quand devrait-on vacciner les patients atteints de PR contre le zona?
Dans des conditions idéales, on devrait proposer le vaccin contre le zona aux patients atteints de PR au plus tard deux semaines avant d’amorcer le traitement immunosuppresseur. Selon la règle établie, il était interdit d’administrer des vaccins vivants aux patients qui recevaient un traitement par les ARMM ou par la prednisone à des doses de 20 mg ou plus par jour. Selon des données récentes, le risque vaccinal est faible en présence d’un traitement par les ARMM classiques et la vaccination de ce sous-groupe de patients est maintenant autorisée15.
Les auteurs d’une étude13 ont répertorié 633 patients ayant reçu le vaccin contre le zona pendant leur traitement par des ARMM biologiques; ces patients n’ont manifesté aucun signe de zona ni de varicelle pendant les
42 jours suivant la vaccination. Ce résultat ne rassure que partiellement parce que les bases de données de réclamations de prestations ne tiennent pas compte des complications vaccinales. Nous avons décrit le cas d’un patient atteint d’un zona circonscrit induit par le vaccin pendant le traitement par l’infliximab (document soumis pour publication). Une nécrose rétinienne causée par le VZV a été décrite chez deux patients immunodéprimés qui avaient reçu le vaccin contre le zona16. À ce stade, on ne peut recommander la vaccination contre le zona pendant que les patients reçoivent un traitement par les ARMM biologiques. D’après les données connues, il semblerait prudent d’interrompre ce traitement pendant l’équivalent de trois demi-vies et de reprendre le traitement par les ARMM biologiques deux semaines après la vaccination.
Retour à notre cas clinique Le traitement du zona dès le stade précoce accélère la résolution des lésions et diminue la gravité de la névrite aiguë, mais l’effet sur le risque de NPH pourrait être négligeable. Le traitement confère les plus grands bienfaits cliniques lorsqu’il est instauré moins de
72 heures après l’apparition des lésions cutanées, en particulier chez les personnes de plus de 50 ans, car elles sont sujettes à des algies plus persistantes. L’instauration sans délai du traitement chez les patients immunodéprimés ou chez le patient atteint d’un zona ophtalmique revêt une importance capitale en raison du risque accru de complications. Ces patients devraient recevoir un traitement antiviral même s’ils consultent le médecin après le délai de 72 heures.
Le patient immunodéprimé atteint d’un zona disséminé ou le patient touché par un zona qui menace la vue devrait être hospitalisé afin de lui administrer l’acyclovir par voie intraveineuse à 10 mg/kg, 3 fois par jour pendant 7 jours. Dans les cas de zona ophtalmique, les patients doivent recevoir des CS topiques en collyre et ils doivent être évalués par un ophtalmologiste. Pour traiter les patients non atteints d’un zona ophtalmique ou ne manifestant pas d’autres complications, nous recommandons d’administrer le valacyclovir à 1 000 mg 3 fois par jour, ou le famciclovir à 500 mg trois par jour, pendant 7 jours. Ces médicaments sont préférables à l’acyclovir pour la voie orale à cause de la faible biodisponibilité de ce dernier et de la posologie plus fréquente.
La meilleure stratégie pour soulager la névrite aiguë est d’instaurer rapidement le traitement antiviral et d’administrer l’amitriptyline à dose faible (25 mg par jour). L’adjonction de CS ou de la gabapentine ne confère pas de bienfaits.
Notre patiente s’est complètement rétablie après avoir été traitée par le valacyclovir à 1 000 mg 3 fois par jour, par l’amitriptyline à 25 mg au coucher, et un CS ophtalmique topique sous la surveillance d’un ophtalmologiste.
Références :
1. Brisson M, Pellissier JM, Camden S, et coll. The potential cost-effectiveness of vaccination against herpes zoster and post-herpetic neuralgia. Hum Vaccin 2008; 4(3):238-45.
2. Javed S, Kamili QU, Mendosa N, et coll. Possible association of lower rate of postherpetic neuralgia in patients on anti-tumor necrosis factor-alpha. J Med Virol 2011; 83(11):2051-5.
3. Wolfe F, Michaud K, Chakravarty EF. Rates and predictors of herpes zoster in patients with rheumatoid arthritis in non-inflammatory musculoskeletal disorders. Rheumatol 2006; 45(11):1370-5.
4. Smitten A, Choi H, Hochberg M, et coll. The risk of herpes zoster in patients with rheumatoid arthritis in the United States and the United Kingdom. Arthritis Rheum 2007; 57(8):1431-8.
5. Strangfeld A, Listing J, Herzer P, et coll. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA 2009; 301(7):737-44.
6. McDonald J, Zeringue A, Caplan L, et coll. Herpes zoster risk factors in a national cohort of veterans with rheumatoid arthritis. Clin Infect Dis 2009; 48(10):1364-71.
7. Winthrop K, Baddley J, Chen L, et coll. Association between the initiation of anti-tumor necrosis factor therapy and the risk of herpes zoster. JAMA 2013; 309(9):887-95.
8. Galloway J, Mercer L, Moseley A, et coll. Risk of skin and soft tissue infections (including shingles) in patients exposed to anti-tumor necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2013; 72(2):229-34.
9. Rimland D, Moanna A. Increasing incidence in herpes zoster among veterans. Clin Infect Dis 2010; 50(7):1000-5.
10. Oxman M, Levin M, Johnson G, et coll. Shingles prevention study group. A vaccine to prevent herpes zoster and post-herpetic neuralgia in older adults. N Engl J Med 2005; 352(22):2271-84.
11. Schmader K, Levin M, Gnann J, et coll. Efficacy, safety, and tolerability of herpes zoster vaccine in persons aged 50-59 years. Clin Infect Dis 2012; 54(7):922-8.
12. Schmader K, Oxman M, Levin M, et coll. Persistence of the efficacy of zoster vaccine in the shingles prevention study and the short-term persistence substudy. Clin Infect Dis 2012; 55(10):1320-8.
13. Zhang J, Xie F, Delzell E, et coll. Association between vaccination for herpes zoster and risk of herpes zoster infection among older patients with selected immune-mediated diseases. JAMA 2012; 308(1):43-9.
14. Tseng H, Chi M, Smith N, et coll. Herpes zoster vaccine and the incidence of recurrent herpes zoster in an immunocompetent elderly population. J Infect Dis 2012; 206(2):190-6.
15. Bombardier C, Hazlewood G, Akhavan P, et coll. Canadian Rheumatology Association recommendations for the pharmacological management of rheumatoid arthritis with traditional and biologic disease-modifying antirheumatic drugs: Part II safety. J Rheumatol 2012; 39(8):1583-602.
16. Charkoudian LD, Kaiser GM, Steinmetz RL, Srivastava SK. Acute retinal necrosis after herpes zoster vaccination. Arch Ophthalmol 2011; 129(11): 1495-7.
Gordon Dow, M.D., FRCPC
Professeur adjoint de clinique, médecine,
Université Dalhousie
Section des maladies infectieuses,
L'Hôpital de Moncton
Moncton, Nouveau-Brunswick |



