Printemps 2014 (volume 24, numéro 1)
Prophylaxie de la tuberculose et traitement de l’arthrite rhumatoïde par les modificateurs de la réponse biologique
par Nicholas M. Baniak, B. S.c., Vernon M. Hoeppner, M.D., FRCPC, et Wojciech P. Olszynski, M.D., Ph. D., FRCPC, CCD
Télécharger le PDF
La tuberculose (TB) est une infection fréquente, principalement latente. On croit que le fait d’être traité par des inhibiteurs du facteur de nécrose tumorale (TNF), un type de modificateur de la réponse biologique (MRB) employé dans le traitement de la polyarthrite rhumatoïde (PR), accroît le risque de réactivation de la TB. Par conséquent, on recommande aux patients atteints de PR de se soumettre au dépistage de la TB latente avant de commencer un traitement par un MRB. Lorsque le dépistage révèle une TB latente chez un patient atteint de PR, il est recommandé d’instaurer une prophylaxie antituberculeuse avant le début du traitement par des inhibiteurs du TNF. Dans la présente étude, un groupe de patients ayant présenté un résultat positif au dépistage de la TB latente n’a pas reçu de prophylaxie antituberculeuse et, par conséquent, il a été soumis à une surveillance étroite des symptômes manifestes de TB. Parmi les 213 patients étudiés, 52 % étaient de sexe masculin, 48 % de sexe féminin et 71 % étaient âgés de plus de 50 ans. En outre, 95 % des patients étaient traités depuis plus d’un an, la plus longue durée de traitement ayant été de 10 ans. Aucun patient n’a présenté de signes de TB active pendant le traitement par des inhibiteurs du TNF.
Introduction
Un tiers de la population mondiale est infecté par la TB1,2, y compris 4 % de la population des États-Unis3. Au Canada, certains groupes ethniques affichent des taux plus élevés de TB latente, par exemple les Canadiens nés à l’étranger et les membres des Premières Nations. On a noté un risque accru de TB associé au traitement par les inhibiteurs du TNF, des médicaments fréquemment employés pour traiter les maladies autoimmunes, p. ex. la PR3. Une étude menée auprès de plus de 112 000 patients canadiens atteints de PR a montré que le taux d’incidence de la TB chez les patients non traités par des inhibiteurs du TNF était de 2,2 pour 1 000 patients, comparativement à 2,6 pour 1 000 patients chez les patients traités par des inhibiteurs du TNF4,5.
Les mycobactéries sont des pathogènes intracellulaires facultatifs1,6. Lorsqu’ils sont inhalés, les bacilles de la TB sont captés par les macrophages alvéolaires; ils sont ensuite séquestrés dans des granulomes afin de limiter la propagation des bactéries infectieuses1,6. Étant donné que l’organisme n’arrive pas à éliminer totalement les pathogènes, la présence de granulomes s’avère un signe caractéristique de l’infection tuberculeuse pulmonaire latente (ITPL)7. La plupart des hôtes immunocompétents élaborent une réaction immunitaire suffisamment puissante contre les mycobactéries de la TB pour réussir à contenir ces pathogènes dans les poumons et les ganglions pulmonaires7,8. La transformation histiocytaire et la formation de granulomes témoignent d’une infection résiduelle6. La réactivation de la maladie survient lorsque les bactéries latentes provenant des granulomes préexistants redeviennent actives et virulentes; cette réactivation s’observe le plus souvent lorsque la réaction immunitaire de l’hôte s’affaiblit ou est supprimée7. La suppression de la réaction immunitaire est un effet indésirable bien connu du traitement par les inhibiteurs du TNF.
L’interaction entre les macrophages activés et les lymphocytes qui sécrètent l’interféron-gamma (IFN-γ) joue un rôle vital dans la maîtrise de l’infection. Le TNF-α, qui est libéré par les immunocytes activés, joue également un rôle important dans la formation et dans l’entretien des granulomes en influant sur l’expression des molécules d’adhésion et des chimiokines9,14. Par conséquent, le traitement par des inhibiteurs du TNF risque d’entraîner un échec de la fonction des granulomes, ce qui se traduirait par la libération des mycobactéries et la réactivation de la TB11. Au cours d’une étude sur un modèle de souris déficiente en TNF, on a observé une infection tuberculeuse rapide et la mort subséquente des souris7,15.
Le dépistage de la TB est recommandé pour rechercher une infection tuberculeuse latente (ITL) chez les patients atteints de PR et candidats à un traitement par des inhibiteurs du TNF16, car des enquêtes ont montré que l’incidence de la TB avait augmenté après l’instauration du traitement par des inhibiteurs du TNF11. Il est donc impératif de diagnostiquer et de traiter l’ITL avant d’amorcer le traitement par des inhibiteurs du TNF afin de réduire au minimum le risque de réactivation de l’infection17.
Selon les recommandations 2012 de l’American College of Rheumatology pour le traitement des patients atteints d’ITL (test cutané à la tuberculine [TCT] positif et radiographie pulmonaire négative), les patients atteints d’ITL doivent recevoir une chimioprophylaxie avant d’entreprendre un traitement par l’un ou l’autre des divers MRB, y compris les inhibiteurs du TNF14.
Le traitement de l’ITL est fondé sur l’isoniazide (INH) à 5 mg/kg (jusqu’à 300 mg) une fois par jour, ou à 15 mg/kg (jusqu’à 900 mg) deux fois par semaine18 pendant neuf mois1,19-21. Toutefois, comme c’est le cas pour tous les médicaments, il importe d’évaluer le risque d’effets indésirables de la prophylaxie antituberculeuse, en particulier le risque d’hépatotoxicité, en regard du bienfait de la prévention de la réactivation de la TB22-24.
À Saskatoon, au Canada, les patients atteints de PR qui affichent un résultat positif au TCT sans présenter aucun autre signe manifeste de TB sont autorisés à recevoir un traitement par des inhibiteurs du TNF (après l’échec du traitement par les antirhumatismaux qui modifient l’évolution de la maladie [ARMM]) sans prophylaxie préalable; ces patients bénéficient d’un suivi étroit à la clinique de TB de Saskatoon. Des patients ayant affiché un TCT positif ont été comparés à des patients traités par des inhibiteurs du TNF, mais dont le TCT avait été négatif pour vérifier si les taux de réactivation de la TB différaient entre les deux groupes. La littérature ne révèle aucun modèle constant de risque de TB grave relié au traitement par les inhibiteurs du TNF25. Selon l’hypothèse de départ de cette étude, les patients ayant un TCT positif n’étaient pas exposés à un risque plus élevé de réactivation de la TB du fait qu’ils étaient traités par des inhibiteurs du TNF.
Cette étude avait pour but de déterminer si les patients qui affichent un résultat positif au dépistage de la TB sont exposés à un risque significativement accru de réactivation de la TB s’ils ne reçoivent pas une chimioprophylaxie, comparativement aux patients qui reçoivent la prophylaxie antituberculeuse.
Contexte et méthodes
La cohorte de cette recherche était composée de tous les patients traités par des MRB au cabinet d’une clinique privée de rhumatologie en milieu urbain ainsi qu’au Royal University Hospital (RUH) à Saskatoon, au Canada. Les dossiers médicaux des patients (n = 213) ont été examinés de 2002 à 2012 en tenant compte des variables suivantes : âge, sexe, type de MRB, types d’ARMM (en particulier la prednisone) et signes de TB active.
Les patients ont été classés en deux groupes : patients qui avaient un TCT positif (> 5 mm) et ceux qui avaiet un TCT négatif (≤ 5 mm). Dans le groupe « TCT positif », 26 patients étaient atteints de PR, huit souffraient de spondylite ankylosante (SA) et cinq manifestaient une arthrite psoriasique (APs). Dans le groupe « TCT négatif », 127 patients étaient atteints de PR, 29 manifestaient une SA et 16 une APs, et deux patients avaient un diagnostic d’arthropathie secondaire à une maladie inflammatoire de l’intestin (MII).
La durée totale du traitement par les MRB a été calculée en mois et en années-patients à cause de la période d’observation variable chez les différents patients. Aucune durée minimale du traitement par les MRB n’avait été établie comme critère d’admissibilité à l’étude, la durée la plus courte ayant été de trois semaines dans le cas d’un patient. Soulignons par ailleurs que seulement deux patients avaient reçu des MRB pendant moins d’un an. Aucun patient n’avait reçu de prophylaxie antituberculeuse.
Résultats
Aucun signe de réactivation de la TB n’a été observé dans l’un ou l’autre groupe de patients. Tous les patients admis à cette étude étaient atteints de PR modérée à grave, comme en témoignait la persistance des symptômes en dépit des traitements avec plusieurs types d’ARMM, ce qui avait motivé le traitement par des inhibiteurs du TNF. Trente-neuf patients du groupe TCT positif continuaient de recevoir des inhibiteurs du TNF et 174 patients du groupe TCT négatif étaient encore traités par des inhibiteurs du TNF. Dans l’un et l’autre groupe, la plupart des patients étaient âgés de plus de 50 ans et ils recevaient un traitement concomitant par des ARMM (Tableau 1). Malgré le traitement par des inhibiteurs du TNF, aucun des patients n’a manifesté de signes de TB active durant le suivi.
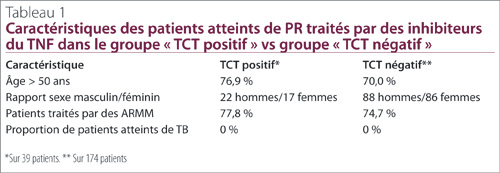
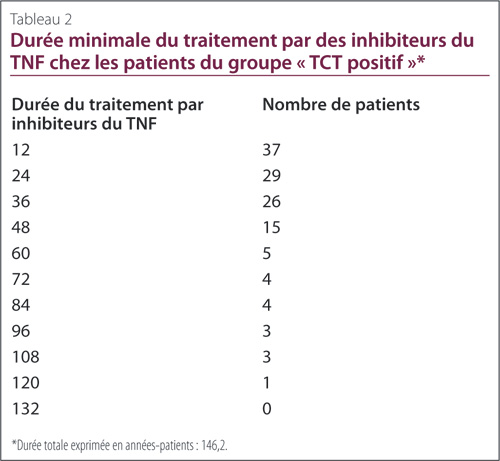
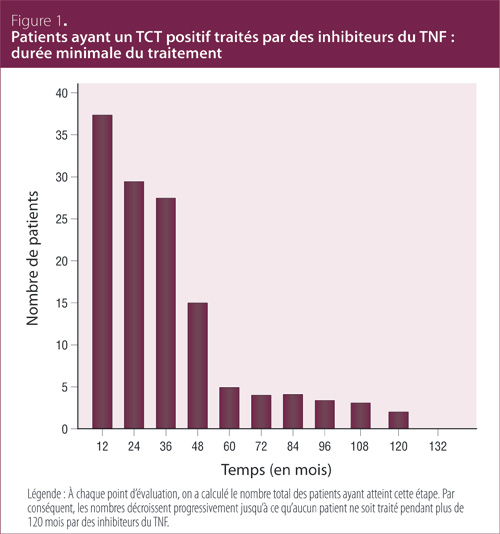
Dans le groupe TCT positif , tous les patients sauf deux ont reçu des inhibiteurs du TNF durant au moins 12 mois, la durée du traitement ayant été de 6,9 et 0,7 mois dans le cas des deux autres patients (Tableau 2). À chaque point d’évaluation, on a calculé le nombre total de patients qui poursuivaient encore le traitement. Ces nombres ont diminué progressivement; aucun patient n’a reçu de MRB pendant plus de 120 mois (Figure 1). Au total, les patients du groupe TCT positif ont accumulé 146 années-patients de traitement par des inhibiteurs du TNF, et dans le groupe TCT négatif, ce chiffre a été de 746 années-patients.
Les patients ont été traités à l’aide d’une gamme d’inhibiteurs du TNF; il était fréquent que les patients reçoivent plus d’un type d’inhibiteur du TNF pendant la durée de leur traitement (Tableau 3). Au total, 74 % des patients du groupe TCT positif et 59 % des patients du groupe TCT négatif ont reçu l’infliximab à un moment ou l’autre, cet agent ayant été l’inhibiteur du TNF le plus souvent employé. Parmi les autres agents, on note par ordre décroissant d’usage, l’adalimumab, l’abatacept, le rituximab, le tocilizumab, l’étanercept et le golimumab. Aucun patient du groupe TCT positif n’a reçu le golimumab.

Pami les 39 patients du groupe TCT positif, 17 (44 %) avaient déjà reçu de la prednisone, et 59 des 174 patients (34 %) du groupe TCT négatif avaient un antécédent de traitement par la prednisone.
Discussion
Malgré un traitement par des inhibiteurs du TNF sans prophylaxie antituberculeuse préalable dans une population de patients jugés à risque de réactivation de la TB, soit des patients ayant obtenu un résultat positif au TCT, aucun cas de réactivation de la TB n’est survenu durant l’étude. Des rapports d’étude ont montré que la majorité des cas de réactivation de l’ITL attribuables à un traitement par des inhibiteurs du TNF sont survenus pendant la phase initiale du traitement4,11,26-28, le délai médian jusqu’à la réactivation étant de 12 à 17 semaines4,11. Cette étude fondée sur l’examen de dossiers médicaux montre que tous les patients sauf deux ont reçu des inhibiteurs du TNF pendant plus de 12 mois. En outre, tous les patients ont fait l’objet d’un suivi étroit à la clinique de TB de Saskatoon pendant les deux années suivant l’instauration du traitement par des inhibiteurs du TNF. Si la TB avait été susceptible d’être réactivée, les cas de réactivation seraient très probablement survenus pendant ces deux années11,26.
Des rapports d’étude montrent que le degré d’accroissement du risque de réactivation de la TB varie selon les différents MRB. Dans une étude, les taux d’incidence de réactivation de la TB les plus élevés ont été observés dans le traitement par l’infliximab (1,5 cas pour 1 000 années-patients); au deuxième rang venait l’adalimumab (0,9 cas pour 1 000 années-patients) et ensuite, l’étanercept (0,5 cas pour 1 000 années-patients)17. D’autres rapports signalent également que l’infliximab entraîne le risque le plus élevé de réactivation de la TB, suivi de l’adalimumab et de l’étanercept26. Selon certaines études, ce risque est trois à quatre fois plus élevé pendant le traitement par l’infliximab ou par l’adalimumab, comparativement à l’étanercept27-29, tandis que d’autres rapports d’étude ne révèlent aucune différence entre l’infliximab, l’adalimumab et l’étanercept sur le plan du risque de réactivation de la TB25.
Aucun modèle constant de risque de TB grave n’a été associé au traitement par les inhibiteurs du TNF25. Le lancement de l’adalimumab a eu lieu après le signalement du risque de TB et la recommandation de procéder au dépistage de cette maladie, ce qui pourrait expliquer la surdéclaration de certains taux d’incidence de TB chez les patients traités par l’adalimumab, une conséquence de la vigilance accrue25. Le mode d’action du rituximab ne suscite pas de crainte de réactivation de la TB chez les patients traités par des inhibiteurs du TNF30. En fait, aucun cas de réactivation de la TB n’a été signalé jusqu’à maintenant chez les patients recevant le rituximab30 et on n’a pas observé une incidence accrue de la TB chez les patients ayant reçu le tocilizumab28. Toutefois, étant donné qu’aucun des patients de notre étude n’a été atteint de TB active, il ne semble pas exister un risque accru relié aux divers médicaments que nous avons administrés.
Comme nous l’avons mentionné, le traitement de choix de l’ITL est l’isoniazide (INH) administrée chaque jour pendant neuf mois1,19,21,22. Le taux d’efficacité de l’INH a atteint 60 % chez des sujets ayant reçu ce médicament chaque jour pendant six mois (taux d’achèvement > 80 %)31,32 et il a été de 90 % lorsque l’INH a été administrée chaque jour pendant neuf mois33. En revanche, le taux d’achèvement est très faible, une étude ayant montré un taux de persévérance de seulement 39 %34 tandis que d’autres rapports indiquent des taux de 50 % à 60 %35,36.
La chimioprophylaxie antituberculeuse entraîne des risques très importants23. Les effets indésirables hépatiques de l’INH vont d’une légère hausse des transaminases (10 % à 20 %) à l’hépatite manifeste (effet rare)24. Les facteurs de risque comprennent un âge > 35 ans, le sexe féminin, des valeurs initiales élevées de la transaminase SPGOT (sérum glutamo-oxalacétique transaminase) et la consommation d’alcool concomitante26,29,37. Plus d’un million de patients ont été traités par l’INH depuis 1991 et on a estimé que le taux d’incidence d’atteinte hépatique reliée à l’INH a été de 1 cas pour 1 000 patients19; on a signalé des taux d’hospitalisation de 0,1 à 0,2 pour 1 000 patients et des taux de mortalité de 0,0 à 0,3 pour 1 000 patients6,20,37. D’après les études de santé publique, les taux d’incidence de l’hépatotoxicité de l’INH ont varié de 0,1 %24 à 4 %38. Les écarts observés pourraient s’expliquer par l’âge de la population ou la définition de l’hépatotoxicité dans ces études39. Au cours d’une autre étude, le taux de manifestations hépatotoxiques a été de 5,63 pour 1 000 patients, des taux plus élevés ayant été observés chez les patients âgés de plus de 50 ans39. Soulignons que dans cette étude d’une base de données, seulement 41 % des patients avaient terminé les trois mois de traitement par l’INH et que seulement 22 % avaient complété six mois de traitement39. Il se peut que le taux de toxicité ait été plus élevé dans certains cas si le taux d’adhésion au traitement était plus élevé39. Au cours d’une étude, 53 % des 255 patients qui avaient terminé les neuf mois de traitement par l’INH ont déclaré avoir manifesté des symptômes pendant le traitement2. Dans cette même étude, l’hépatotoxicité a motivé l’abandon chez 40 % des patients qui ont dû cesser le traitement de manière permanente2.
La décision thérapeutique met en conflit deux types de risque : les risques reliés aux inhibiteurs du TNF et à la réactivation de la TB, et les risques de toxicité de l’INH et de l’adhésion à la chimioprophylaxie. Si le risque annualisé de TB est plus élevé que celui de l’hépatite médicamenteuse, le patient devrait recevoir la prophylaxie22. À l’opposé, si le risque d’hépatite est plus élevé, le patient ne devrait pas recevoir la prophylaxie, mais il devrait faire d’objet d’un suivi très attentif pour surveiller l’apparition de symptômes et, le cas échéant, d’une évaluation et d’un diagnostic sans délai22. Lorsque le risque surpasse les bienfaits, les patients ayant des résultats radiographiques pulmonaires anormaux évoquant une TB passée (ou qui ont un antécédent de TB extrapulmonaire traitée adéquatement dans le passé) peuvent commencer le traitement par des inhibiteurs du TNF, à condition d’être soumis à un suivi clinique tous les trois mois22. Par contre, si aucun traitement n’avait été administré antérieurement, l’analyse risque-avantage plaide en faveur de la chimioprophylaxie antituberculeuse22.
À titre d’exemple, envisageons le traitement dans le cas d’un patient ordinaire atteint de PR et qui habite en Saskatchewan. Le taux d’incidence de la TB au Canada est de 5,1 cas pour 100 000 habitants, mais il est un peu plus élevé en Saskatchewan, soit 6,2 cas pour 100 000. Dans certaines populations de la Saskatchewan, les taux d’incidence de la TB diffèrent notablement : moins de 1 cas pour 100 000 chez les personnes de race blanche, 43 cas pour 100 000 chez les membres inscrits des Premières Nations, 23 cas pour 100 000 chez les Métis et 17 cas pour 100 000 chez les Canadiens nés à l’étranger31.
À l’échelle mondiale, le taux d’incidence de la progression de l’ITL à la TB active est estimé à 10 % en présence d’un TCT positif31. En Saskatchewan, ce taux est de 0,8 % et 6,9 % chez les Canado-Européens de race blanche et les membres inscrits des Premières Nations, respectivement31. Pour calculer le risque, on multiplie le risque annualisé de TB par cinq (à cause du risque accru relié au traitement par les inhibiteurs du TNF) afin de tenir compte des inhibiteurs du TNF22; le produit est divisé par le risque d’hépatite secondaire au traitement par l’INH31. Un rapport inférieur à un signifie que l’observation est le meilleur choix, tandis qu’un rapport supérieur à un signifie que la prophylaxie est l’intervention la plus souhaitable31. Le taux d’incidence serait calculé en tenant compte des statistiques épidémiologiques locales pour le groupe de patients ainsi que de la toxicité, soit 278 cas pour 100 000 personnes31. Par exemple, pour un Saskatchewanais de race blanche, le risque se calculerait comme suit : [1 cas pour 100 00] multiplié par 5, puis divisé par [278 cas pour 100 000], ce qui donne un ratio de 0,02, donc fortement en faveur de l’observation31. Même pour un Saskatchewanais des Premières Nations, le rapport serait de 0,8 ([43 cas pour 100 000] multiplié par 5, puis divisé par 278 cas pour 100 000)30.
Dans cette étude, 76,2 % des patients atteints de PR traités par des inhibiteurs du TNF dans le groupe TCT positif étaient âgés de plus de 50 ans; leur risque de toxicité aurait été plus élevé. De même, le rapport risque-avantage était inférieur à un chez tous les patients. En théorie, donc, tous les patients avaient un risque moindre s’ils ne recevaient pas de prophylaxie. Ainsi, en plus d’éviter un risque accru pour le patient, la décision de ne pas administrer de prophylaxie épargnait des coûts au système de santé. Selon une étude réalisée à l’aide de données financières provenant de Montréal, Canada, le coût estimé de traiter un seul patient par l’INH pendant neuf mois s’élevait à 1 073 $ si aucun symptôme ne se manifestait, et de 1 131 $ en cas de symptômes n’empêchant pas de mener le traitement à terme2. Les coûts étaient attribuables aux visites régulières, aux agents thérapeutiques, aux frais de pharmacie, aux épreuves de laboratoire courantes et aux consultations imprévues. Les coûts reliés à l’évaluation et au traitement de certaines manifestations indésirables étaient de l’ordre de 668 $ à 1 249 $, selon la gravité de la manifestation indésirable2. Bien que le médicament employé pour traiter l’ITL soit peu coûteux, le coût total de la pharmacothérapie est élevé en raison de la surveillance très étroite que motive le risque d’hépatite médicamenteuse, une précaution vitale pour ces patients2.
Le risque exact de morbidité tuberculeuse relié au traitement par les corticostéroïdes (CS) n’est pas établi, mais le traitement par les CS est un facteur de risque de TB bien connu40. Il existe des cas documentés de cas de réactivation de la TB chez des patients ayant été traités par des CS41-43. Les CS exercent un effet immunosuppresseur, ce qui peut promouvoir la réactivation de la TB; par conséquent, il importe de surveiller très attentivement les patients traités par les CS42,44. Toutefois, aucune relation n’a été établie entre la dose totale ou la durée du traitement et le risque42.
Une des limites de cette étude est le petit nombre de patients (39) ayant un TCT positif, ce qui nous empêche de comparer les résultats avec ceux d’études antérieures. Le risque prévu de TB chez des patients ayant un TCT positif traités par des inhibiteurs du TNF étant de 2,6 cas pour 1 000 patients, il aurait fallu que l’étude compte environ 400 patients pour détecter un cas de TB. La population de la Saskatchewan est trop petite pour offrir des nombres suffisants de patients. Nous croyons savoir que la Saskatchewan est le seul endroit où les patients ayant un TCT positif peuvent commencer un traitement par des MRB sans recevoir au préalable une chimioprophylaxie antituberculeuse. Par conséquent, tous les patients doivent habiter en Saskatchewan, un obstacle très important au recrutement d’un nombre suffisant de patients pour les études.
Même si les nombres de patients admis à cette étude ne permettent pas de comparer les degrés de risque avec ceux observés dans d’autres études, cette recherche a montré qu’aucun des patients atteints de PR traités par des inhibiteurs du TNF n’a manifesté une réactivation de la TB.
Conclusion et sommaire
Au cours de cette étude, nous avons démontré que les patients atteints de PR traités par des inhibiteurs du TNF sans avoir préalablement reçu une chimioprophylaxie antituberculeuse ne sont pas à risque de subir une réactivation de la TB. Bien que nous n’ayons pas pu répondre complètement à la question objective pour déterminer si les patients sont exposés à un risque accru s’ils ne reçoivent pas de prophylaxie, notre étude a permis d’explorer la possibilité de traiter la PR par des MRB dans le cas de patients atteints d’une infection tuberculeuse latente sans leur administrer au préalable une prophylaxie antituberculeuse. Il faudrait une population de 400 à 5 000 patients pour démontrer objectivement que le risque de réactivation de la TB n’est pas accru, mais les résultats de notre étude suggèrent à tout le moins que tel est le cas. D’autres études devront être menées, assorties d’un suivi plus long de manière à accumuler plus de données.
Références :
1. Winthrop KL. Update on tuberculosis and other opportunistic infections associated with drugs blocking tumour necrosis factor {alpha}. Ann Rheum Dis 2005; 64 Suppl 4:iv29-30.
2. Aspler A, Long R, Trajman A, et coll. Impact of treatment completion, intolerance and adverse events on health system costs in a randomised trial of 4 months rifampin or 9 months isoniazid for latent TB. Thorax 2010; 65(7):582-7.
3. Bennett DE, Courval JM, Onorato I, et coll. Prevalence of tuberculosis infection in the United States population: the national health and nutrition examination survey, 1999–2000. Am J Respir Crit Care 2008; 177(3):348-55.
4. Patkar NM, Teng GG, Curtis JR, et coll. Association of infections and tuberculosis with antitumor necrosis factor alpha therapy. Curr Opin Rheumatol 2008; 20(3):320-6.
5. Brassard P, Kezouh A, Suissa S. Antirheumatic drugs and the risk of tuberculosis. Clin Infect Dis 2006; 43(6):717-22.
6. Villiger PM, Zellweger JP, Möller B. Novel screening tools for latent tuberculosis: time to leave an old friend? Curr Opin Rheumatol 2009; 21(3):238-43.
7. Gupta A, Kaul A, Tsolaki AG, et coll. Mycobacterium tuberculosis: immune evasion, latency and reactivation. Immunobiology 2012; 217(3):363-74.
8. Gomez JE, McKinney JD, M. tuberculosis persistence, latency, and drug tolerance. Tuberculosis (Edinb) 2004; 84(1-2):29-44.
9. Tufariello JM, Chan J, Flynn JL. Latent tuberculosis: mechanisms of host and bacillus that contribute to persistent infection. Lancet Infect Dis 2003; 3(9):578-90.
10. Gardam MA, Keystone EC, Menzies R, et coll. Anti-tumour necrosis factor agents and tuberculosis risk: mechanisms of action and clinical management. Lancet Infect Dis 2003; 3(3):148-55.
11. Keane J, Gershon S, Wise RP, et coll. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345(15):1098-104.
12. Settas LD, Tsimirikas G, Vosvotekas G, et coll. Reactivation of pulmonary tuberculosis in a patient with rheumatoid arthritis during treatment with IL-1 receptor antagonists (anakinra). J Clin Rheumatol 2007; 13(4):219-20.
13. Lin PL, Plessner HL, Voitenok NN, et coll. Tumor necrosis factor and tuberculosis. J Investig Dermatol Symp Proc 2007; 12(1):22-5.
14. Lin PL, Flynn JL. Understanding latent tuberculosis: a moving target. J Immunol 2010; 185(1):15-22.
15. Botha T, Ryffel B. Reactivation of latent tuberculosis infection in TNF- deficient mice. J Immunol 2003; 171(6):3110-8.
16. Singh JA, Furst DE, Bharat A, et coll. 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012; 64(5):625-39.
17. Dixon WG, Watson K, Lunt M, et coll. British Society for Rheumatology Biologics Register. Rates of serious infection, including site-specific and bacterial intracellular infection, in rheumatoid arthritis patients receiving anti–tumor necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum 2006; 54(8):2368-76.
18. American Thoracic Society (ATS) and Centers for Disease Control Prevention (CDC). Targeted tuberculin testing and treatment of latent tuberculosis infection. Am J Respir Crit Care Med 2000; 161(4 Pt 2):S221-47.
19. CDC. Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR Mortal Morb Wkly Rep 2000; 49(6):1-51.
20. Targeted tuberculin testing and treatment of latent tuberculosis infection. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, July 1999. This is a joint statement of the American Thoracic Society (ATS) and the Centers for Disease Control and Prevention (CDC). This statement was endorsed by the Council of the Infectious Diseases Society of America (IDSA), September 1999, and the sections of this statement. Am J Respir Crit Care Med 2000; 161(4 pt 2):S221-47.
21. Long R. Canadian tuberculosis standards. 6th ed. Ottawa, ON, Canada: Canadian Lung Association & Public Health Agency of Canada, 2007.
22. British Thoracic Society Standards of Care Committee. BTS recommendations for assessing risk and for managing Mycobacterium tuberculosis infection and disease in patients due to start anti-TNF-alpha treatment. Thorax 2005; 60(10):800-5.
23. da Rocha Castelar Pinheiro G. Rheumatoid arthritis and tuberculosis in the tumor necrosis factor inhibitors era: observations from Brazil. J Clin Rheumatol 2005; 11(6):344-6.
24. Nolan CM, Goldberg SV, Buskin SE. Hepatotoxicity associated with isoniazid preventive therapy: a 7-year survey from a Public Health Tuberculosis Clinic. JAMA 1999; 281(11):1014-8
25. Dixon WG, Watson K, Lunt M, et coll. British Society for Rheumatology Biologics Register. Rates of serious infection, including site-specific and bacterial intracellular infection, in rheumatoid arthritis patients receiving anti-tumor necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum 2006; 54(8):2368-76.
26. Szeto T, Peterson J, Silva F. A case of tuberculous peritonitis in the United States in a patient with rheumatoid arthritis treated with adalimumab. J Clin Rheumatol 2010; 16(3):135-7.
27. Tubach F, Salmon D, Ravaud P, et coll. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than soluble tumor necrosis factor receptor therapy. Arthritis Rheum 2009; 60(7):1884-94.
28. Campbell L, Chen C, Bhagat SS, et coll. Risk of adverse events including serious infections in rheumatoid arthritis patients treated with tocilizumab: a systematic literature review and meta-analysis of randomized controlled trials. Rheumatology (Oxford) 2011; 50(3):552-62.
29. Jung N, Owczarczyk K, Hellmann M, et coll. Efficacy and safety of rituximab in a patient with active rheumatoid arthritis and chronic disseminated pulmonary aspergillosis and history of tuberculosis. Rheumatology (Oxford) 2008; 47(6):932-3.
30. Burr ML, Malaviya AP, Gaston JH, et coll. Rituximab in rheumatoid arthritis following anti-TNF-associated tuberculosis. Rheumatology (Oxford) 2008; 47(5):738-9.
31. Hoeppner V, Olszynski W. Prophylactic treatment of T infection: risks vs. benefits. Personal communications, 2006.
32. Smieja MJ, Marchetti CA, Cook DJ, et coll. Isoniazid for preventing tuberculosis in non-HIV infected persons (Cochrane Review). Cochrane Database Syst Rev 2000; (2):CD001363.
33. Comstock GW. How much isoniazid is needed for prevention of tuberculosis among immunocompetent adults? Int J Tuberc Lung Dis 1999; 3(10):847-50.
34. Horsburgh CR Jr, Goldberg S, Bethel J, et coll. Tuberculosis Epidemiologic Studies Consortium. Latent TB infection treatment acceptance and completion in the United States and Canada. Chest 2010; 137(2):401-9.
35. Page KR, Sifakis F, Montes de OR, et coll. Improved adherence and less toxicity with rifampin vs isoniazid for treatment of latent tuberculosis: a retrospective study. Arch Intern Med 2006; 166(17):1863-70.
36. Jasmer RM, Nahid P, Hopewell PC. Latent tuberculosis infection. N Engl J Med 2002; 347(23):1860-6.
37. Bruns H, Meinken C, Schauenberg P, et coll. Anti-TNF immunotherapy reduces CD8+ T cell-mediated antimicrobial activity against Mycobacterium tuberculosis in humans. J Clin Invest 2009; 119(5):1167-77.
38. McNeill L, Allen M, Estrada C, Cook P. Pyrazinamide and rifampin vs isoniazid for the treatment of latent tuberculosis: improved completion rates but more hepatotoxicity. Chest 2003; 123(1):102-6.
39. Fountain FF, Tolley E, Chrisman CR, et coll. Isoniazid hepatotoxicity associated with treatment of latent tuberculosis infection: a 7-year evaluation from a public health tuberculosis clinic. Chest 2005; 128(1):116-23.
40. Bass JB Jr, Farer LS, Hopewell PC, et coll. Treatment of tuberculosis and tuberculosis infection in adults and children. American Thoracic Society and The Centers for Disease Control and Prevention. Am J Respir Crit Care Med 1994; 149(5):1359-74.
41. Haanaes OC, Bergmann A. Tuberculosis emerging in patients treated with corticosteroids. Eur J Respir Dis 1983; 64(4):294-7.
42. Kobashi Y, Matsushima T. Clinical analysis of pulmonary tuberculosis in association with corticosteroid therapy. Intern Med 2002; 41(12):1103-10.
43. Sahn SA, Lakshminarayan S. Tuberculosis after corticosteroid therapy. Br J Dis Chest 1976; 70(3):195-205.
44. Senderovitz T, Viskum K. Corticosteroids and tuberculosis. Respir Med 1994; 88(8):561-5.
Nicholas M. Baniak, B. Sc.
Collège de médecine,
Université de la Saskatchewan
Saskatoon, Saskatchewan
Vernon M. Hoeppner, M.D., FRCPC
Professeur et chef,
Département de médecine
Collège de médecine,
Université de la Saskatchewan
Saskatoon, Saskatchewan
Wojciech P. Olszynski, M.D., Ph. D., FRCPC, CCD
Professeur de clinique, médecine
Directeur,
Saskatoon Osteoporosis and Arthritis Infusion Centre
Consul honoraire de la République de Pologne à Saskatoon
Saskatoon, Saskatchewan |



